Vaccins contre la COVID-19 et effets indésirables d’intérêt particulier : une étude de cohorte multinationale du Global Vaccine Data Network (GVDN) portant sur 99 millions de personnes vaccinées
Source : https://www.sciencedirect.com/science/article/pii/S0264410X24001270
Arrière-plan
Le projet mondial sur la sécurité des vaccins contre la COVID-19 (GCoVS), lancé en 2021 dans le cadre du Réseau mondial de données sur les vaccins (GVDN®), vise à évaluer l’innocuité des vaccins. Cette étude visait à évaluer le risque d’ effets indésirables particuliers (EIPP) suite à la vaccination contre la COVID-19 sur dix sites répartis dans huit pays.
Méthodes
À l’aide d’un protocole commun, cette étude de cohorte observationnelle a comparé les taux observés et attendus de 13 effets indésirables graves (EI) sélectionnés pour les résultats neurologiques, hématologiques et cardiaques. Les taux attendus ont été obtenus par les sites participants à partir des données de santé pré-vaccinales COVID-19, stratifiées par âge et par sexe. Les taux observés ont été rapportés à partir des mêmes bases de données de santé depuis le déploiement du programme de vaccination contre la COVID-19. Les EI survenant jusqu’à 42 jours après la vaccination par les vaccins à ARNm (BNT162b2 et ARNm-1273) et à vecteur adénoviral (ChAdOx1) ont été inclus dans l’analyse principale. Les risques ont été évalués à l’aide des ratios observés/attendus (OE) avec des intervalles de confiance à 95 %. Les signaux de sécurité potentiels prioritaires étaient ceux dont la limite inférieure de l’intervalle de confiance à 95 % (LBCI) était supérieure à 1,5.
Résultats
Français Les participants comprenaient 99 068 901 personnes vaccinées. Au total, 183 559 462 doses de BNT162b2, 36 178 442 doses d’ARNm-1273 et 23 093 399 doses de ChAdOx1 ont été administrées dans les sites participants au cours de la période d’étude. Les périodes à risque suivant les calendriers de vaccination homologues ont contribué à 23 168 335 années-personnes de suivi. Des ratios OE avec LBCI > 1,5 ont été observés pour le syndrome de Guillain-Barré (2,49, IC à 95 % : 2,15, 2,87) et la thrombose du sinus veineux cérébral (3,23, IC à 95 % : 2,51, 4,09) après la première dose du vaccin ChAdOx1. L’encéphalomyélite aiguë disséminée a montré un ratio d’efficacité de 3,78 (IC à 95 % : 1,52, 7,78) après la première dose du vaccin à ARNm-1273. Les ratios d’efficacité de la myocardite et de la péricardite après BNT162b2, ARNm-1273 et ChAdOx1 ont augmenté significativement avec des LBCI > 1,5.
Conclusion
Cette analyse multi-pays a confirmé les signaux de sécurité préétablis concernant la myocardite , la péricardite , le syndrome de Guillain-Barré et la thrombose du sinus veineux cérébral . D’autres signaux de sécurité potentiels nécessitant une investigation plus approfondie ont été identifiés.
Questions répondues dans cet article
Bêta propulsé par GenAI
Il s’agit d’un contenu d’IA génératif et la qualité peut varier. Apprendre encore plus .
précédent Article dans le numéro Prochain article du numéro
Mots-clés
Surveillance de la sécurité des vaccins
Pharmacovigilance
Effets indésirables après la vaccination
Événements indésirables présentant un intérêt particulier
COVID 19
Analyse observée vs. attendue
1. Introduction
Depuis la déclaration de la pandémie de COVID-19 par l’Organisation mondiale de la santé (OMS) le 11 mars 2020 [1], plus de 13,5 milliards de doses de vaccins contre la COVID-19 ont été administrées dans le monde [2] . En novembre 2023, au moins 70,5 % de la population mondiale avait reçu au moins une dose d’un vaccin contre la COVID-19 [2] . Ce scénario sans précédent souligne le besoin urgent d’une surveillance complète de la sécurité des vaccins, car de très rares événements indésirables associés aux vaccins contre la COVID-19 pourraient n’être révélés qu’après l’administration à des millions de personnes.
Français En prévision de ce déploiement mondial sans précédent de vaccins contre la COVID-19, l’initiative Safety Platform for Emergency vACcines (SPEAC) a formulé une liste d’événements indésirables potentiels du vaccin contre la COVID-19 présentant un intérêt particulier (AESI) en 2020 [3] . La sélection des AESI était basée sur leurs associations préétablies avec la vaccination, des plateformes vaccinales ou des adjuvants spécifiques, ou la réplication virale au cours d’une maladie de type sauvage ; des préoccupations théoriques liées à l’immunopathogenèse ; ou des preuves à l’appui provenant de modèles animaux utilisant des plateformes vaccinales candidates [3] .
Français Une approche flexible pour évaluer les EISP est la comparaison des taux d’EISP observés après l’introduction d’un programme de vaccination avec les taux attendus (ou de fond) basés sur des périodes historiques avant le déploiement du vaccin [4] , [5] . De telles comparaisons peuvent être effectuées rapidement et peuvent jouer un rôle clé dans la détection précoce de signaux potentiels de sécurité des vaccins ou lorsque les agences de réglementation et de santé publique ont besoin d’une évaluation rapide d’un signal de sécurité émergent [4] , [6] . L’analyse observée versus (vs.) attendue (OE) a joué un rôle essentiel dans l’identification de la thrombose avec syndrome de thrombocytopénie (TTS) comme un signal de sécurité, ce qui a conduit à la suspension de l’utilisation du ChAdOx1 (vaccin AstraZeneca COVID-19) le 11 mars 2021, au Danemark et en Norvège [7] , [8] .
Français Ces évaluations sont utiles non seulement au début du déploiement à grande échelle des vaccins, mais aussi à mesure que le programme de vaccination mûrit, en particulier si elles peuvent être menées dans un contexte multinational. Nous avons mené une étude de cohorte mondiale en suivant le protocole d’étude Observed vs. Expected Analyses of COVID-19 Adverse Events of Special Interest [9] avec des données provenant de 10 sites dans huit pays participant au projet unique Global COVID Vaccine Safety (GCoVS) [10] du Global Vaccine Data Network™ (GVDN®) [11] . Le projet GCoVS, lancé en 2021, est une collaboration mondiale financée par les Centers for Disease Control and Prevention (CDC) entre des chercheurs et des sources de données de plusieurs pays à des fins de surveillance de la sécurité des vaccins contre la COVID-19.
2. Méthodes
2.1 . Conception de l’étude
Cette étude observationnelle rétrospective a été conçue pour estimer les ratios OE d’EIS sélectionnés après la vaccination contre la COVID-19 dans une cohorte de population multi-pays.
2.2 . Source des données et population étudiée
Le projet GCoVS a compilé des données de santé électroniques sur les effets indésirables graves (EIS) liés aux vaccins contre la COVID-19 auprès de participants de plusieurs sites du réseau GVDN, notamment en Argentine, en Australie (Nouvelle-Galles du Sud), en Australie (Victoria), au Canada (Colombie-Britannique), au Canada (Ontario), au Danemark, en Finlande, en France, en Nouvelle-Zélande et en Écosse [10] . Les données de santé comprenaient des données individuelles ou populationnelles, selon la disponibilité dans les sites d’étude ( tableau supplémentaire 1 ).
La majorité des sites d’étude ont utilisé des registres de vaccination contenant des données individuelles. Ces registres couvraient la même population et la même région géographique que les ensembles de données utilisés pour calculer les taux de base. Nous avons également examiné les données populationnelles sur la couverture vaccinale à l’aide de tableaux de bord régulièrement mis à jour par les sites d’étude. Si le nombre de personnes vaccinées par tranches d’âge et de sexe spécifiques était disponible, nous avons converti ces chiffres en années-personnes en fonction de la période de risque post-vaccinale. Contrairement aux registres contenant des données individuelles, les strates d’âge et de sexe utilisées dans cette approche pourraient ne pas correspondre à celles utilisées pour le calcul des taux de base.
Les participants étaient des personnes vaccinées contre la COVID-19 au sein des populations représentées par les sites. Dans la mesure du possible, des méthodes standardisées ont été appliquées entre les sites. Les types de patients comprenaient des patients hospitalisés (Australie – Nouvelle-Galles du Sud, France, Nouvelle-Zélande, Écosse) et des patients hospitalisés et ambulatoires aux urgences (Argentine, Australie – Victoria, Canada, Danemark, Finlande). Dans les pays où les types de patients n’étaient pas clairement définis, la durée du contact à l’hôpital a été utilisée comme indicateur indirect des types de patients. À titre d’exemple, une durée de contact de cinq heures ou plus a été utilisée comme indicateur indirect des patients hospitalisés au Danemark. Les caractéristiques spécifiques des sources de données et des données par site sont présentées dans le tableau supplémentaire 1 .
2.3 . Période d’étude et suivi
Français Les périodes d’étude variaient selon les pays, commençant à la date du déploiement du programme de vaccination contre la COVID-19 spécifique au site et se terminant à la fin de la disponibilité des données ( tableau 1 ). En général, les périodes d’étude s’étendaient de décembre 2020 à août 2023. La période d’étude la plus courte observée a eu lieu en Australie – Nouvelle-Galles du Sud, comprenant 11 mois de février 2021 à décembre 2021. L’Argentine a eu la période d’étude la plus longue, de décembre 2020 à août 2023, comprenant un total de 32 mois.
Tableau 1. Résumé de la population par site. (Uniquement les vaccins Pfizer/BioNTech BNT162b2, Moderna mRNA-1273 et Oxford/Astra Zeneca/Serum Institute of India ChAdOx1 et les doses 1 à 4 inclus).

Vaccins : Pfizer/BioNTech (BNT162b2), Moderna (ARNm-1273) et Oxford/Astra Zeneca/Serum Institute of India (ChAdOx1).
Français Les intervalles de risque utilisés après chaque dose étaient de 0 à 7 jours, de 8 à 21 jours, de 22 à 42 jours et de 0 à 42 jours. Pour chaque dose de vaccination, le jour 0 était le jour de la réception du vaccin. Pour ce manuscrit, nous présentons les résultats pour l’intervalle de risque de 0 à 42 jours uniquement. D’autres données sont présentées sur le tableau de bord du GVDN avec toutes les dernières mises à jour des sites participants [12] . Les événements survenus en dehors de la période d’étude n’ont pas été inclus. Une période de sevrage de 365 jours pour les événements survenus a été utilisée pour définir les événements incidents. Les événements survenus étaient considérés comme incidents s’il n’y avait pas d’enregistrement du même événement survenu au cours de la période de sevrage de 365 jours précédente. Un individu peut avoir contribué à plusieurs événements survenus à condition qu’ils soient séparés dans le temps par au moins la période de sevrage de 365 jours.
2.4 . Variables et résultats de l’étude
2.4.1 . Événements indésirables présentant un intérêt particulier (EIIP)
vaccinale en situation réelle Treize affections représentant des EISP d’une pertinence spécifique pour le paysage actuel de la pharmacovigilance ont été sélectionnées dans la liste compilée par le projet SPEAC de la Brighton Collaboration [3] et en réponse aux signaux de sécurité de la thrombose avec syndrome de thrombocytopénie [7] , [8] ( tableau supplémentaire 2 ). Les affections choisies correspondaient aux EISP pour lesquels les taux de base ont été récemment générés par les sites GVDN [13] . Les EISP ont été identifiés à l’aide des codes harmonisés de la Classification internationale des maladies, 10e révision (CIM-10). Les affections neurologiques sélectionnées comprenaient le syndrome de Guillain-Barré (SGB), la myélite transverse (MT), la paralysie faciale (de Bell), l’encéphalomyélite aiguë disséminée (ADEM) et les convulsions (crises généralisées (GS) et convulsions fébriles (CF)) car des signaux de sécurité potentiels ont été identifiés pour certaines de ces affections [14] , [15] , [16] . Les affections hématologiques comprenaient une thrombose du sinus veineux cérébral (TSVC), une thrombose de la veine splanchnique (TSV) et une embolie pulmonaire. (EP) ; les thromboses de sites inhabituels (CVST et SVT) ont été sélectionnées comme marqueurs de TTS potentiel qui pourraient être identifiés avec précision à l’aide de codes de diagnostic [17] , [18] . La thrombocytopénie et la thrombocytopénie immunitaire (ITP) ont également été incluses en raison de leur association avec le TTS et des rapports d’ITP comme signal de sécurité indépendant [7] , [19] , [20] . La myocardite et la péricardite ont été incluses comme affections cardiovasculaires et les ratios OE ont été évalués séparément pour chaque affection [21] , [22] , [23] .
2.4.2 . Vaccins contre la COVID-19
En novembre 2023, plusieurs vaccins contre la COVID-19 étaient utilisés par les sites GCoVS, représentant plusieurs types de plateformes, telles que les plateformes à vecteurs viraux inactivés, à base d’acide nucléique (ARNm), à base de protéines et non réplicatifs ( tableau 2 ). Pour ce manuscrit, nous nous sommes concentrés sur les trois vaccins ayant enregistré le plus grand nombre de doses administrées : Pfizer/BioNTech BNT162b2, Moderna mRNA-1273 et Oxford/Astra Zeneca/Serum Institute of India ChAdOx1. Français Le nombre cumulé de doses d’autres vaccins administrées (n) dans les sites d’étude était relativement faible, à l’exception des vaccins inactivés Sinopharm (n = 134 550) et Sinovac (n = 31 598), du vaccin à base de protéines Novavax (n = 66 856) et des vaccins à vecteur adénoviral Janssen/Johnson & Johnson (n = 1 137 505) et Gamaleya Research Institute/Sputnik (n = 84 460). Le nombre total de doses de chaque marque de vaccin administrées est indiqué dans le tableau 2. Les données sur l’exposition au vaccin contre la COVID-19 par plateforme/type, marque et dose étaient disponibles au niveau individuel pour déterminer le nombre de cas observés par type/marque de vaccin et profil de dose et dans l’intervalle de risque post-vaccination de 0 à 42 jours.
Tableau 2. Nombre total de vaccinations par marque.
| Plateforme de vaccins | Marque de vaccin | Doses totales |
|---|---|---|
| Inactivé | Vaccin Covilo ou SARS-CoV-2 (cellule Vero) [Sinopharm (Pékin)] | 134 550 |
| Covaxin [Bharat Biotech] | 1 660 | |
| CoronaVac ou Sinovac [Sinovac Biotech] | 31 598 | |
| Inactivé (cellule Vero) [Sinopharm (Wuhan)] | 623 | |
| À base d’acide nucléique | Vaccin bivalent Comirnaty ou Riltozinaméran ou Pfizer/BioNTech contre la COVID-19 [Pfizer/BioNTech] | 3 516 963 |
| Comirnaty ou Tozinameran [Pfizer/BioNTech ou Fosun-BioNTech] | 183 677 660 | |
| Comirnaty ou Tozinameran pédiatrique [Pfizer/BioNTech ou Fosun-BioNTech] | 2 439 086 | |
| Spikevax bivalent Original/Omicron [Moderna] | 2 750 476 | |
| Demi-dose d’élasomeran ou de Spikevax ou de TAK-919 [Moderna ou Takeda] | 400 395 | |
| Élasomérane ou Spikevax ou TAK-919 [Moderna ou Takeda] | 36 222 514 | |
| À base de protéines | MVC-COV1901 [Medigen] | 16 |
| Covovax ou Nuvaxoid [Novavax ou Serum Institute of India] | 66 856 | |
| Vecteur viral non réplicatif | Convidacia ou Convidance [CanSino] | 3 938 |
| Covishield ou Vaxzevria [AstraZeneca ou Serum Institute of India] | 23 094 620 | |
| Spoutnik Light ou Gam-COVID-Vac [Institut de recherche Gamaleya] | 26 | |
| Spoutnik V [Institut de recherche Gamaleya] | 84 460 | |
| Janssen [Janssen/Johnson & Johnson] | 1 137 505 |
2.5 . Analyse statistique
2.5.1 . Calcul des ratios observés/attendus pour chaque site
Français Pour chaque site, nous avons calculé le nombre observé d’événements pour chaque EISP dans l’intervalle de risque après l’introduction de la vaccination contre la COVID-19. Pour calculer le nombre attendu de cas, nous avons utilisé les données sur les taux de base pré-vaccination contre la COVID-19 de 2015 à 2019 (2019-2020 pour le Danemark) collectées dans l’étude GCoVS Background Rates of EISP Following COVID-19 vaccination [13] . La période de suivi observée en personnes-années pour un profil de vaccination donné et la période post-vaccinale a été stratifiée selon le groupe d’âge et le sexe. Chacune des personnes-années stratifiées selon l’âge et le sexe a été multipliée par le taux de base stratifié selon l’âge et le sexe correspondant. Cela a donné le nombre attendu de cas dans chaque strate, qui ont ensuite été additionnés pour donner le nombre total de cas attendus pendant la période de suivi observée.
Les ratios d’efficacité globale agrégés par dernière dose ont été calculés en divisant le nombre de cas observés par le nombre de cas attendus après la vaccination ; des intervalles de confiance (IC) à 95 % ont été obtenus selon la distribution exacte de Poisson. Nous avons également calculé les ratios d’efficacité globale pour les schémas homologues des vaccins BNT162b2, mRNA-1273 et ChAdOx1 jusqu’à quatre doses. Les ratios d’efficacité globale agrégés et spécifiques aux schémas homologues sont présentés.
We considered an OE ratio a potential safety signal of concern where the lower bound of the 95 % CI (LBCI) was greater than one and reached statistical significance [5]. However, we prioritised potential safety signals of concern for further evaluation where the LBCI was greater than 1.5, due to increased statistical evidence and the higher likelihood of being a true signal, based on expert opinion from the CDC and GVDN collaborators.
2.5.2 . Combinaison des résultats entre sites
Les résultats ont été agrégés sur l’ensemble des sites en additionnant le nombre d’événements observés pour chaque EISP et les années-personnes stratifiées selon l’âge et le sexe pour un profil de vaccination et une période post-vaccinale donnés. Pour chaque EISP, les profils vaccinaux individuels ont été rapportés si le nombre cumulé de suivis (en années-personnes) dans la période de 0 à 42 jours après la vaccination était de 10 000 ou plus. Le nombre combiné d’événements et le ratio d’événements indésirables ont été calculés avec des IC à 95 % dérivés de la distribution exacte de Poisson. Aucun événement (c’est-à-dire zéro) observé pour une marque de vaccin et un profil de dose n’a été rapporté séparément sans IC.
2.5.3 . Analyse de sensibilité
Premièrement, nous avons réalisé des analyses de sensibilité spécifiques à chaque site afin d’explorer plus en détail les associations potentielles entre les signaux de sécurité les plus significatifs identifiés dans l’analyse principale. Les taux observés rapportés par site ont été pris en compte dans l’analyse en fonction des contraintes suivantes. Pour chaque marque de vaccin, profil de dose et combinaison de période post-vaccinale, les ratios d’événements indésirables graves et l’IC à 95 % ont été supprimés si moins de cinq événements étaient observés. Deuxièmement, nous avons réalisé une analyse complémentaire incluant d’autres vaccins et doses administrés entre les sites. Le seuil de déclaration en personnes-années a été abaissé de 10 000 à 1 000 personnes-années par rapport à l’analyse principale des ratios d’événements indésirables graves agrégés, ce qui a permis d’analyser un plus large éventail de vaccins.
2.6 . Approbation éthique
L’approbation des comités d’éthique de la recherche humaine compétents a été obtenue ou une exemption a été obtenue pour tous les sites participants ( tableau supplémentaire 3 ).
3. Résultats
Français La population totale vaccinée sur l’ensemble des sites comprenait 99 068 901 personnes. La plupart des vaccinés appartenaient aux tranches d’âge de 20 à 39 ans et de 40 à 59 ans ( Tableau 1 ). Au total, 183 559 462 doses de BNT162b2, 36 178 442 doses d’ARNm-1273 et 23 093 399 doses de ChAdOx1 ont été administrées sur l’ensemble des sites au cours des périodes d’étude. Le plus grand nombre de doses a été administré en France (120 758 419), suivie du Canada – Ontario (32 159 817) et de l’Australie – Victoria (15 617 627). Au total, 23 168 335 personnes-années ont contribué aux ratios OE pour l’AESI suivant les calendriers homologues. Le résumé de la population est présenté dans le tableau 1 , et des informations plus détaillées sur les autres vaccins administrés sont présentées dans le tableau supplémentaire 4. Dans les sections de résultats ci-dessous, nous fournissons à la fois les ratios d’efficacité globale agrégés ( tableau 3 , tableau 4 , tableau 5 ) et les ratios d’efficacité globale détaillés pour les calendriers homologues ( figure 1 , figure 2 , figure 3 ), y compris le nombre d’événements et de personnes-années. Globalement, 95,8 % et 86,6 % des vaccinations ont été incluses dans l’analyse des calendriers agrégés et homologues, respectivement ( Tableau supplémentaire 5 ). Les principaux résultats des sites individuels ainsi que les périodes de risque supplémentaires et les méta-analyses pour chaque AESI sont disponibles dans le tableau de bord interactif GVDN Observed vs Expected (OE) [12] .
Tableau 3. Ratios OE agrégés par dernière dose, affections neurologiques, période 0–42 jours.

AESI : SGB = syndrome de Guillain-Barré, TRM = myélite transverse, BP = paralysie faciale (de Bell), ADEM = encéphalomyélite aiguë disséminée, FSZ = convulsions fébriles,
GSZ = Crises généralisées.
Vaccins : Pfizer/BioNTech (BNT162b2), Moderna (ARNm-1273) et Oxford/Astra Zeneca/Serum Institute of India (ChAdOx1).
Tableau 4. Ratios OE agrégés par dernière dose, conditions hématologiques, période 0–42 jours.

AESI: THR = Thrombocytopenia, ITP = Idiopathic thrombocytopenia, PEM = Pulmonary embolism, CVST = Cerebral venous sinus thrombosis, SVT = Splanchnic vein thrombosis.
Vaccines: Pfizer/BioNTech (BNT162b2), Moderna (mRNA-1273), and Oxford/Astra Zeneca/Serum Institute of India (ChAdOx1).
Table 5. Aggregated OE Ratios by last dose, cardiovascular conditions, period 0–42 days.




3.1 . Affections neurologiques
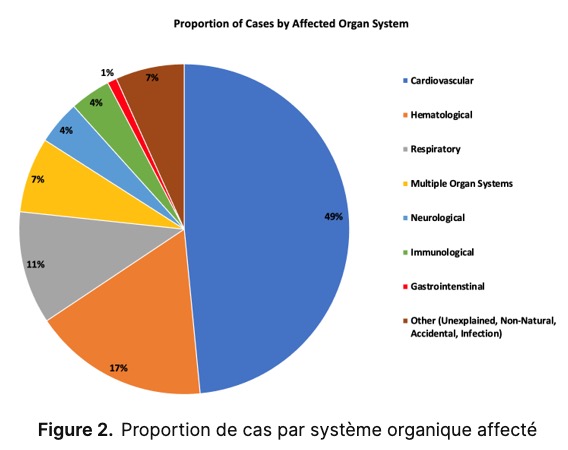
Français Il y a eu une augmentation statistiquement significative des cas de SGB dans les 42 jours suivant une première dose de ChAdOx1 (ratio OE = 2,49 ; IC à 95 % : 2,15, 2,87), indiquant un signal de sécurité prioritaire ( Tableau 3 ). Soixante-seize événements de SGB étaient attendus et 190 événements ont été observés ( Fig. 1 ). Le ratio OE pour l’ADEM dans les 42 jours suivant une première dose d’ARNm-1273 a également atteint le seuil de signification d’un signal de sécurité prioritaire (3,78 ; IC à 95 % : 1,52, 7,78), avec deux événements attendus contre sept événements observés ( Fig. 1 ).
Français Des différences statistiquement significatives ont également été trouvées pour la myélite transverse (ratio OE = 1,91 ; IC à 95 % : 1,22, 2,84) et l’ADEM (ratio OE = 2,23 ; IC à 95 % : 1,15, 3,90) après une première dose de ChAdOx1. La paralysie de Bell avait un ratio OE accru après une première dose de BNT162b2 (1,05 ; IC à 95 % : 1,00, 1,11) et d’ARNm-1273 (1,25 ; IC à 95 % : 1,11, 1,39). Français On a également observé une augmentation des ratios d’OE pour les convulsions fébriles après une première et une deuxième dose d’ARNm-1273 (1,36, IC à 95 % : 1,02, 1,77 et 1,44, IC à 95 % : 1,04, 1,95, respectivement), et pour les convulsions généralisées après une première dose d’ARNm-1273 (1,15, IC à 95 % : 1,10, 1,20) et une quatrième dose de BNT162b2 (1,09, IC à 95 % : 1,04, 1,14). Aucune augmentation des ratios d’OE n’a été identifiée après une troisième dose d’un vaccin. Les résultats concordent avec les ratios d’OE des calendriers homologues ; Cependant, un ratio OE accru pour les crises généralisées après un schéma homologue de quatre doses d’ARNm-1273 (1,33 ; IC à 95 % : 1,07, 1,63) a été identifié ( Fig. 1 ). Ces résultats n’ont pas atteint le seuil d’un signal de sécurité prioritaire après la vaccination.
3.2 . Affections hématologiques
Le rapport OE de CVST était de 3,23 (IC à 95 % : 2,51–4,09) dans les 42 jours suivant une première dose de ChAdOx1, remplissant le seuil d’un signal de sécurité prioritaire ( Tableau 4 ). Au total, 21 événements étaient attendus, tandis que 69 événements ont été observés ( Fig. 2 ).
Français Des ratios OE accrus ont également été identifiés pour la thrombocytopénie après une première dose de ChAdOx1 (1,07 ; IC à 95 % : 1,03, 1,12), BNT162b2 (1,11 ; IC à 95 % : 1,08, 1,14) et mRNA-1273 (1,33 ; IC à 95 % 1,25, 1,42), ainsi qu’après une troisième dose de ChAdOx1 (1,95 ; IC à 95 % : 1,29, 2,84). La thrombocytopénie immunitaire a également démontré des ratios OE accrus après une première dose de ChAdOx1 (1,40 ; IC à 95 % : 1,24, 1,58) et BNT162b2 (1,08 ; IC à 95 % : 1,01, 1,16). Français Les ratios OE d’embolie pulmonaire ont augmenté après les premières doses de ChAdOx1 (1,20 ; IC à 95 % : 1,16, 1,24), BNT162b2 (1,29 ; IC à 95 % : 1,26, 1,32) et mRNA-1273 (1,33, IC à 95 % : 1,26, 1,40), ainsi qu’après une troisième dose de ChAdOx1 (1,88 ; IC à 95 % : 1,32, 2,58). Le ratio OE de CVST était de 1,49 (IC à 95 % : 1,26, 1,75) après une première dose et de 1,25 (IC à 95 % : 1,06, 1,46) après une deuxième dose de BNT162b2. Français Un ratio OE accru pour la tachycardie supraventriculaire a été observé après une première dose de BNT162b2 (1,25 ; IC à 95 % : 1,17, 1,34) et d’ARNm-1273 (1,23 ; IC à 95 % : 1,03, 1,47) ; une deuxième dose d’ARNm-1273 (1,17 ; IC à 95 % : 1,01, 1,36) ; et une quatrième dose de BNT162b2 (1,30, IC à 95 % : 1,06, 1,59) et d’ARNm-1273 (1,53, IC à 95 % : 1,05, 2,16). Ces résultats n’ont pas atteint le seuil d’un signal de sécurité prioritaire après la vaccination.
3.3 . Affections cardiovasculaires
Français Des ratios OE accrus satisfaisant le seuil des signaux de sécurité prioritaires pour la myocardite ont été systématiquement identifiés après une première, une deuxième et une troisième dose de vaccins à ARNm (BNT162b2 et ARNm-1273) ( Tableau 4 ). Le ratio OE le plus élevé a été observé après une première et une deuxième dose d’ARNm-1273 (3,48 ; IC à 95 % : 3,00, 4,01 et 6,10 ; IC à 95 % : 5,52, 6,72, respectivement). Le ratio OE après une troisième dose d’ARNm-1273 était de 2,01 (IC à 95 % : 1,60, 2,49). Le nombre d’événements pour un maximum de quatre doses de calendriers homologues est présenté dans la Fig. 3. Les ratios OE des calendriers homologues correspondent aux ratios OE agrégés. L’OE homologue pour la myocardite après quatre doses du vaccin à ARNm-1273 n’a pas pu être estimé en raison d’un manque d’événements observés.
Français De même, le ratio OE pour la péricardite a atteint le seuil d’un signal de sécurité prioritaire après une première et une quatrième dose d’ARNm-1273, avec des ratios OE de 1,74 (IC à 95 % : 1,54, 1,97) et 2,64 (IC à 95 % : 2,05, 3,35) respectivement. Un ratio accru de 6,91 (IC à 95 % : 3,45, 12,36), atteignant le seuil d’un signal de sécurité prioritaire, a également été observé après une troisième dose de ChAdOx1. Les ratios OE agrégés pour la péricardite ont augmenté après toutes les doses des trois vaccins présentés ( Tableau 4 ). Français Les résultats sont très similaires aux ratios des schémas homologues ( Fig. 3 ), à l’exception du ratio OE de 1,23 (IC à 95 % : 0,45–2,69) après réception de la quatrième dose d’ARNm-1273, qui n’a pas atteint le seuil de signal de sécurité. Le ratio OE homologue après une troisième dose de ChAdOx1 n’a pas été rapporté car seul un petit nombre de troisièmes doses de ChAdOx1 ont été administrées dans les sites d’étude ( Tableau 1 ).
3.4 . Analyse de sensibilité
Français Des analyses secondaires ont été menées pour explorer plus en détail le SGB, l’ADEM, la TVC, la myocardite et la péricardite au niveau du site spécifique. Nous rapportons les ratios d’OE agrégés par dernière dose et site dans la période de 0 à 42 jours après la vaccination dans les tableaux supplémentaires 6 à 10. Il n’a pas été possible de rapporter les résultats pour tous les sites et les résultats de l’étude en raison d’un nombre insuffisant de personnes-années ou de moins de cinq événements observés selon les critères de confidentialité du site. La majorité des signaux de sécurité identifiés suite à des combinaisons spécifiques de marques et de doses de vaccins dans l’analyse principale ont cependant été confirmés par les sites individuels où les données étaient disponibles. L’analyse supplémentaire avec un seuil de personnes-années de 1 000 et incluant d’autres vaccins et doses administrés dans les sites GVDN, a montré un ratio d’OE accru pour certains résultats, par exemple pour les crises généralisées après une première dose du vaccin Gamaleya Research Institute/Sputnik (5,50, IC à 95 % : 2,74, 9,84) ( Tableaux supplémentaires 11 à 13 ).
4. Discussion
multinationale Cette étude de cohorte a été menée dans le cadre unique du GVDN. À ce jour, le nombre d’études de grande envergure, coordonnées systématiquement et portant sur des zones géographiques et des populations diverses, est limité. Cependant, plusieurs études ont déjà évalué les risques liés aux signaux de sécurité identifiés après la vaccination contre la COVID-19, principalement dans des contextes monocentriques. Nous avons étudié l’association entre la vaccination contre la COVID-19 et 13 effets indésirables graves (EIS) comprenant des affections neurologiques, hématologiques et cardiovasculaires sur 10 sites répartis dans huit pays, dont l’Europe, l’Amérique du Nord, l’Amérique du Sud et l’Océanie. Dans cette étude incluant plus de 99 millions de personnes vaccinées contre le SARS-CoV-2, le risque jusqu’à 42 jours après la vaccination était généralement similaire au risque de base pour la majorité des résultats ; cependant, quelques signaux de sécurité potentiels ont été identifiés. Nous avons observé des signaux de sécurité potentiels pour le SGB et la TVC après la première dose de ChAdOx1, sur la base de plus de 12 millions de doses administrées.
Français Dans l’ensemble, les études sur les vaccins à base de vecteurs tels que le ChAdOx1 ont observé une incidence plus élevée de SGB après la vaccination par rapport à l’incidence de base ; alors que la plupart des études sur les vaccins à ARNm , tels que le BNT162b2 et l’ARNm-1273, n’ont pas observé d’augmentation de SGB [15] , [24] , [14] , [25] , [26] , [27] . Atzenhoffer et al. [24] ont signalé un ratio OE élevé > 2,0 pour les vaccins COVID-19 à vecteur adénovirus, dans les pays contribuant à VigiBase, une base de données internationale sur les effets indésirables des médicaments et Patone et al. [27] ont signalé 38 cas excédentaires de SGB pour 10 millions de personnes exposées au cours de la période à risque de 1 à 28 jours suivant la vaccination avec le ChAdOx1 en Angleterre. Les auteurs n’ont pas observé de risque accru chez ceux qui ont reçu le BNT162b2. En revanche, une étude de Li et al. [28] n’ont montré aucun risque accru de SGB pour ChAdOx1, tandis que seule l’infection par le SARS-CoV-2 était associée à un risque plus élevé. Cet écart, comparé aux résultats de Patone et al. [27] , pourrait toutefois s’expliquer par un échantillon plus petit et des mesures de résultats différentes. Globalement, ces données corroborent nos conclusions concernant un signal d’alerte concernant le SGB après la vaccination par ChAdOx1. Bien que rare, cette association a été reconnue par l’OMS, l’Agence européenne des médicaments (EMA) et la Therapeutic Goods Administration (TGA) d’Australie, ce qui a conduit à classer le SGB comme une maladie rare. effet secondaire suite à une exposition à ChAdOx1 [15] , [29] , [30] .
Français Le risque accru de TVC identifié après la vaccination par ChAdOx1 dans cette étude est corroboré par de multiples études. Un ratio OE accru a été observé dans une étude de cohorte nationale au Danemark et en Norvège, avec des taux accrus d’ événements thromboemboliques veineux , y compris la TVC avec un taux excédentaire de 2,5 événements pour 100 000 vaccinations après ChAdOx1 [7] . Sur la base de diverses méthodologies, d’autres études ont également signalé une incidence accrue de TVC après la vaccination [31] , [32] . En fin de compte, ce signal de sécurité rare mais préoccupant a conduit au retrait du vaccin ChAdOx1 des programmes de vaccination contre la COVID-19 ou à la mise en œuvre de restrictions basées sur l’âge dans plusieurs pays [8] .
Il est crucial de reconnaître le seuil de signification des signaux de sécurité prioritaires appliqués dans cette étude (LBCI > 1,5). Ce seuil a été sélectionné sur la base de l’avis d’experts au sein du GVDN et des CDC, afin de se concentrer sur les résultats les plus susceptibles d’être de véritables signaux. Certains événements observés, bien que n’atteignant pas ce seuil, peuvent néanmoins avoir une importance clinique et nécessiter des investigations plus approfondies. Par exemple, un PTI avec un ratio OE > 1,0 et un LBCI de 1,2 après vaccination par ChAdOx1 concorde avec les résultats rapportés dans la littérature comme un signal potentiel. Cette concordance est mise en évidence dans une étude menée à Victoria, en Australie, qui a observé un taux de PTI nettement plus élevé que prévu après vaccination par ChAdOx1 [33] .
Français De plus, nous avons observé des risques significativement plus élevés de myocardite après les première, deuxième et troisième doses de BNT162b2 et d’ARNm-1273 ainsi que de péricardite après la première et la quatrième dose d’ARNm-1273, et la troisième dose de ChAdOx1, dans la période à risque de 0 à 42 jours. Les taux élevés de péricardite après la vaccination par ChAdOx1 identifiés dans cette étude reposent sur un nombre limité de décomptes observés dans la méta-analyse. Le large intervalle de confiance souligne l’incertitude substantielle de la caractérisation de la péricardite comme un signal de sécurité après la vaccination par ChAdOx1. Cependant, notre étude confirme les résultats de cas rares de myocardite et de péricardite précédemment identifiés après la première et la deuxième dose de vaccins à ARNm [21] , [22] , [23] , [34] . Une vaste étude de cohorte portant sur 23,1 millions de résidents de quatre pays nordiques a révélé un risque accru de myocardite chez les jeunes hommes âgés de 16 à 24 ans, sur la base de 4 à 7 événements excédentaires en 28 jours pour 100 000 vaccinés après une deuxième dose de BNT162b2, et entre 9 et 28 pour 100 000 vaccinés après une deuxième dose de mRNA-1273 [22] . De même, des études menées en Colombie-Britannique, au Canada, ont signalé que les cas de myocardite étaient plus élevés chez les personnes ayant reçu une deuxième dose par rapport à une troisième dose, et chez celles ayant reçu une deuxième dose du vaccin à ARNm-1273 par rapport au vaccin BNT162b2 [35] , [36] . Patone et al. [37] ont estimé que les événements de myocardite supplémentaires se situaient entre un et 10 par million de personnes au cours du mois suivant la vaccination, ce qui était nettement inférieur aux 40 événements supplémentaires par million de personnes observés après la période d’infection par le SRAS-CoV-2. Une revue systématique d’Alami et al. [38] a conclu que les personnes vaccinées à l’ARNm étaient deux fois plus susceptibles de développer une myocardite/péricardite que les personnes non vaccinées, avec un rapport de taux de 2,05 (IC à 95 % 1,49–2,82). Compte tenu des preuves, l’OMS a publié des directives actualisées concernant ces signaux de sécurité et la vaccination à ARNm contre la COVID-19, et l’EMA a fourni des mises à jour des informations sur le produit pour les vaccins BNT162b2 et ARNm-1273 [21] , [23] . La TGA ainsi que les CDC continuent de surveiller et d’examiner les données sur la myocardite et la péricardite après la vaccination contre la COVID-19. [39] , [40] .
Français Un autre signal de sécurité potentiel a été identifié pour l’ADEM après la première dose du vaccin à ARNm-1273, avec cinq événements observés de plus que prévu sur la base de 1 035 871 personnes-années et 10,5 millions de doses administrées ; cependant, le nombre de cas de cet événement rare était faible et l’intervalle de confiance large, de sorte que les résultats doivent être interprétés avec prudence et confirmés dans de futures études. Bien que certains rapports de cas aient suggéré une association possible entre la vaccination contre la COVID-19 et l’ADEM, il n’y avait pas de tendance cohérente en termes de vaccin ou de moment après la vaccination, et des études épidémiologiques de plus grande envergure n’ont confirmé aucune association potentielle [41] , [42] , [43] , [44] . De plus, les rapports de cas peuvent faire état d’événements fortuits et n’établissent pas d’association ni n’indiquent de causalité, par conséquent des études observationnelles de plus grande envergure sont nécessaires pour approfondir nos résultats. Pour y remédier, une étude de suivi est actuellement menée au sein du GVDN, se concentrant sur un groupe démographique non inclus dans notre analyse. Sur la base des rapports de cas rares d’ADEM à la base de données européenne des effets indésirables suspectés des médicaments, l’EMA a évalué l’association potentielle d’ADEM après la vaccination avec ChAdOx1 [45] . Frontera et al. [46] ont conclu que les risques d’avoir un événement neurologique après une infection aiguë par le SRAS-CoV-2 étaient jusqu’à 617 fois plus élevés qu’après une vaccination contre la COVID, ce qui suggère que les avantages de la vaccination l’emportent largement sur les risques. Un signal de sécurité pour les crises généralisées a été identifié après la vaccination Gamaleya Research Institute/Sputnik, mais le nombre de vaccinations était relativement faible par rapport aux autres vaccins dans cette étude. D’autres études sont nécessaires pour explorer ce signal de sécurité potentiel.
La réalisation d’une analyse de cohorte dans le contexte multi-pays unique du GVDN s’appuie sur un bassin de données vaste et diversifié. L’agrégation de données provenant de plusieurs pays, portant sur plus de 99 millions de personnes vaccinées, a considérablement augmenté la taille de l’échantillon et la puissance statistique par rapport à de nombreuses études de sécurité antérieures. Cela améliore la capacité à détecter les signaux d’innocuité, notamment pour les effets indésirables extrêmement rares, car la taille plus importante de l’échantillon permet une estimation plus précise des taux observés.
Les résultats basés sur des données provenant d’Europe, d’Amérique du Nord et du Sud, ainsi que d’Océanie, offrent une validité externe plus solide, permettant une généralisation plus large des résultats à un éventail plus large de populations et de structures de santé participant au programme mondial de vaccination contre la COVID-19. De plus, les analyses multi-pays facilitent les comparaisons entre des pays ayant des stratégies de vaccination, des caractéristiques démographiques et des systèmes de santé différents, ce qui permet de mieux comprendre l’influence de ces facteurs sur les profils de sécurité vaccinale. Les données utilisées dans notre analyse proviennent de plusieurs bases de données, notamment des bases de données de santé, des registres nationaux de vaccination et des tableaux de bord de vaccination, ce qui permet d’identifier des signaux potentiels de sécurité provenant de diverses sources.
Les résultats de notre étude doivent toutefois être interprétés en tenant compte de multiples limites. Nos analyses impliquent intrinsèquement une hétérogénéité dans la collecte, la qualité et les normes de déclaration des données entre les pays. Ces différences dans les infrastructures de santé et les systèmes de surveillance peuvent introduire des biais et affecter la comparabilité des résultats. Les sites participants des huit pays ont mis en œuvre des stratégies de vaccination variées, notamment en ce qui concerne les types de vaccins, les schémas posologiques et la priorisation des vaccinés. De plus, les analyses multipays sont sensibles aux facteurs de confusion démographiques, tels que les différences dans les conditions de santé préexistantes, les facteurs génétiques , les profils ethniques et les comportements, qu’il n’a pas été possible de prendre en compte dans notre analyse. Nous considérons que notre approche est adaptée à une application à de grands ensembles de données représentant des populations moyennes. Cependant, les taux historiques spécifiques à l’âge et au sexe qui ne sont pas ajustés pour des facteurs tels que les maladies antérieures peuvent ne pas fournir une comparaison pertinente, par exemple, dans les premières phases d’une campagne de vaccination où les personnes présentant des comorbidités ont été vaccinées avant les autres groupes de population.
La sous-déclaration potentielle entre les pays pourrait avoir conduit à une sous-estimation de l’importance des signaux potentiels de sécurité. Il est important de reconnaître le risque de faux négatifs , en particulier lors de la détection d’associations avec des intervalles de confiance inférieurs à 1,5 qui maintiennent une signification statistique. Les signaux de sécurité identifiés dans cette étude doivent être évalués en fonction de leur rareté, de leur gravité et de leur pertinence clinique. De plus, les évaluations globales du rapport bénéfice/risque de la vaccination doivent tenir compte du risque associé à l’infection, car plusieurs études ont démontré un risque plus élevé de développer les événements étudiés, tels que le syndrome de Guillain-Barré (SGB), la myocardite ou l’EMA, après une infection par le SARS-CoV-2 que la vaccination. Enfin, l’utilisation des codes CIM-10 est soumise à des considérations de spécificité et de sensibilité, et son application peut varier selon les pays.
5. Conclusion
Les analyses comparatives observées/attendues dans le contexte multi-pays du GVDN et du projet GCoVS offrent un ensemble de données plus vaste et plus diversifié, une meilleure généralisabilité et une puissance statistique accrue par rapport aux études monocentriques ou régionales. Elles présentent également des défis liés à l’hétérogénéité des données, aux facteurs de confusion démographiques et aux variations des stratégies de vaccination et des systèmes de déclaration. L’implication de chercheurs et de sources de données provenant de diverses régions du monde favorise l’inclusion, réduit les biais potentiels et encourage la collaboration dans la poursuite d’un objectif commun de santé publique. Bien que notre étude ait confirmé des signaux d’innocuité rares identifiés suite à la vaccination contre la COVID-19 et apporté des preuves sur plusieurs autres résultats importants, des investigations complémentaires sont nécessaires pour confirmer les associations et évaluer la signification clinique . Ceci pourrait être abordé en menant des études d’association spécifiques à des résultats individuels en appliquant des méthodologies telles que les séries de cas auto-contrôlées (SCCS) pour valider les associations. [6] .
Clause de non-responsabilité
Toutes les analyses, conclusions, opinions et déclarations sont celles des auteurs et ne représentent pas nécessairement le point de vue officiel des CDC/HHS ou du gouvernement américain, ni leur approbation. Pour plus d’informations, veuillez consulter cdc.gov.
.
Certaines parties de ce document sont basées sur des données et/ou des informations compilées et fournies par l’Institut canadien d’information sur la santé et le ministère de la Santé de l’Ontario. Les analyses, conclusions, opinions et déclarations exprimées ici sont celles des auteurs et ne reflètent pas celles des sources de financement ou de données ; aucune approbation n’est prévue ni ne doit être déduite. Certaines parties de ce document sont basées sur des données et/ou des informations fournies par le ministère de la Santé de la Colombie-Britannique. Toutes les inférences, opinions et conclusions tirées de ce manuscrit sont celles des auteurs et ne reflètent pas les opinions ou les politiques du ou des responsables des données.
Déclaration de financement
Le projet GCoVS est soutenu par les Centers for Disease Control and Prevention (CDC) du Département de la Santé et des Services Sociaux des États-Unis (HHS) dans le cadre d’une aide financière d’un montant total de 10 108 491 USD, financée à 100 % par le CDC/HHS .
Le site ontarien contribuant à cette étude a été soutenu par Santé publique Ontario et par l’ ICES , qui est financé par une subvention annuelle du ministère de la Santé de l’Ontario de l’ . JCK est soutenu par une bourse de clinicien-chercheur du département de médecine familiale et communautaire Université de Toronto .
Déclaration de contribution d’auteur Crédit
K. Faksova : Visualisation, Rédaction – brouillon original, Rédaction – révision et édition. D. Walsh : Conservation des données, Analyse formelle, Investigation, Méthodologie, Logiciel, Validation, Conceptualisation, Rédaction – révision et édition, Visualisation. Y. Jiang : Conceptualisation, Conservation des données, Analyse formelle, Investigation, Méthodologie, Logiciel, Supervision, Validation, Visualisation, Rédaction – révision et édition. J. Griffin : Conceptualisation, Rédaction – révision et édition, Méthodologie. A. Phillips : Conceptualisation, Méthodologie, Rédaction – révision et édition, Investigation, Validation. A. Gentile : Conservation des données, Investigation, Supervision, Validation. JC Kwong : Conservation des données, Supervision, Validation, Rédaction – révision et édition, Investigation, Méthodologie. K. Macartney : Conservation des données, Supervision, Validation, Rédaction – révision et édition, Investigation, Méthodologie. M. Naus : Conservation des données, Supervision, Validation, Investigation, Méthodologie. Z. Grange : Conservation des données, Supervision, Validation, Conceptualisation, Investigation, Méthodologie. S. Escolano : Conservation des données, Supervision, Validation, Investigation, Méthodologie, Rédaction – révision et édition. G. Sepulveda : Conservation des données, Analyse formelle, Logiciel, Validation. A. Shetty : Conservation des données, Validation, Investigation, Méthodologie. A. Pillsbury : Conservation des données, Validation, Investigation, Méthodologie, Rédaction – révision et édition. C. Sullivan : Conservation des données, Validation, Investigation, Méthodologie, Rédaction – révision et édition. Z. Naveed : Conservation des données, Validation, Investigation, Méthodologie, Rédaction – révision et édition. NZ Janjua : Conservation des données, Rédaction – révision et édition. N. Giglio : Conservation des données, Investigation, Méthodologie, Validation. J. Perälä : Conservation des données, Investigation, Méthodologie, Validation. S. Nasreen : Conceptualisation, Conservation des données, Validation, Rédaction – révision et édition. H. Gidding : Conceptualisation, Validation, Rédaction – révision et édition, Investigation, Méthodologie. P. Hovi : Conceptualisation, Validation, Rédaction (révision et correction), Investigation, Méthodologie. T. Vo : Conceptualisation, Validation, Analyse formelle, Investigation, Méthodologie, Rédaction – révision et édition. F. Cui : Conceptualisation, Investigation, Méthodologie, Validation. L. Deng : Conceptualisation, Investigation, Méthodologie, Validation, Rédaction – révision et édition. L. Cullen : Conceptualisation, Investigation, Méthodologie, Validation, Rédaction – révision et édition. M. Artama : Conceptualisation, Investigation, Méthodologie, Validation, Rédaction – révision et édition. H. Lu : Conservation des données, Analyse formelle, Logiciel, Validation. HJ Clothier : Conceptualisation, Méthodologie, Validation, Rédaction – révision et édition, Conservation des données, Analyse formelle, Administration de projet. K. Batty : Conceptualisation, Méthodologie, Administration de projet, Validation, Rédaction – révision et édition. J. Paynter : Conceptualisation, Méthodologie, Supervision, Conservation des données, Analyse formelle, Rédaction – révision et édition. H. Petousis-Harris : Conceptualisation, Acquisition de financement, Enquête, Méthodologie, Ressources, Supervision, Rédaction – révision et édition, Administration de projet. J. Buttery : Conceptualisation, Acquisition de financement, Investigation, Méthodologie, Ressources, Supervision, Validation, Rédaction – révision et édition, Administration de projet. S. Black : Conceptualisation, Acquisition de financement, Investigation, Méthodologie, Administration de projet, Ressources, Supervision, Validation, Rédaction – révision et édition. A. Hviid : Conceptualisation, Investigation, Méthodologie, Supervision, Validation, Rédaction – révision et édition.
Déclaration d’intérêts concurrents
Français Les auteurs déclarent les intérêts financiers/relations personnelles suivants qui peuvent être considérés comme des intérêts concurrents potentiels : Jeffrey C. Kwong rapporte que le soutien financier a été fourni par les Centers for Disease Control and Prevention. Naveed Z. Janjua rapporte que le soutien financier a été fourni par les Centers for Disease Control and Prevention. Anders Hviid rapporte que le soutien financier a été fourni par le Global Vaccine Data Network. Helen Petousis-Harris rapporte que le soutien financier a été fourni par le ministère de la Santé de la Nouvelle-Zélande. Steven Black rapporte une relation avec GSK qui comprend : des services de consultation ou de conseil. Jeffrey C. Kwong rapporte une relation avec les Instituts de recherche en santé du Canada qui comprend : des subventions de financement. Jeffrey C. Kwong rapporte une relation avec l’Agence de la santé publique du Canada qui comprend : des subventions de financement. Naveed Z. Janjua rapporte une relation avec AbbVie Inc qui comprend : des services de consultation ou de conseil et des honoraires de conférencier et de conférence. Naveed Z. Janjua rapporte une relation avec Gilead Sciences Inc qui comprend : des honoraires de conférencier et de conférence. Anders Hviid rapporte une relation avec l’Independent Research Fund Denmark qui comprend : des subventions de financement. Anders Hviid déclare entretenir des relations avec la Fondation Lundbeck, notamment des subventions de financement. Anders Hviid déclare entretenir des relations avec la Fondation Novo Nordisk, notamment des subventions de financement. Anders Hviid déclare entretenir des relations avec VAC4EU, notamment des activités de conseil ou de consultation. L’Institut finlandais pour la santé et le bien-être (THL) mène des partenariats public-privé avec des fabricants de vaccins et a reçu des financements de recherche de Sanofi Inc. Petteri Hovi a participé à ces études en tant que chercheur, mais n’a perçu aucune rémunération personnelle. Helen Petousis-Harris a siégé à des comités consultatifs d’experts et a donné des conférences pour Pfizer et GSK. Elle a également reçu des financements de recherche de GSK. Elle n’a perçu aucun honoraire personnel. Si d’autres auteurs sont présents, ils déclarent n’avoir aucun intérêt financier concurrent ni aucune relation personnelle connus qui auraient pu influencer les travaux présentés dans cet article.
Remerciements
Le protocole d’étude des analyses observées et attendues des événements indésirables du vaccin contre la COVID-19 d’intérêt particulier a été développé par le groupe de travail observé et attendu dirigé par Anders Hviid. a, b Les membres du groupe de travail étaient Nelson Aguirre Duarte c , Miia Artama d , Karin Batty et , Steven Black c, f , Hannah Chisholm c , Hazel Clothier g, h, i , Fuqiang Cui j , Lucy Deng k Lucy Cullen l , Heather Gidding k, m, n , Petteri Hovi le , Yannan Jiang c Janine Paynter c , Helen Petousis-Harris c Anastasia Phillips k , John Sluyter c , Thuan Vo faire , et Daniel Walsh c , Éric Weintraub p .
Affiliations aux groupes de travail
a. Statens Serum Institut, Danemark ; b. Université de Copenhague, Danemark ; c. Université d’Auckland, Nouvelle-Zélande ; d. Université de Tampere, Finlande ; e. Auckland UniServices Limited à l’Université d’Auckland, Nouvelle-Zélande ; f. Université de Cincinnati et Hôpital pour enfants, États-Unis ; g. Département de la santé de Victoria, Australie ; h. Institut de recherche pour enfants Murdoch, Australie ; i. Centre d’analyse de la santé, Campus pour enfants de Melbourne, Australie ; j. Université de Pékin, Pékin, Chine ; k. Centre national de recherche sur l’immunisation et de surveillance des maladies évitables par la vaccination, Australie ; l. Public Health Scotland, Glasgow, Écosse, Royaume-Uni ; m. Institut Kolling, District sanitaire local de Northern Sydney, Australie ; n. École clinique du Nord de l’Université de Sydney, Australie ; o. Institut finlandais pour la santé et le bien-être, Finlande ; p. Vaccine Safety Datalink, Centres pour le contrôle et la prévention des maladies.
Les personnes suivantes ont contribué en tant que responsables de site du GVDN : Anders Hviid (Danemark) ; Angela Gentile (Argentine) ; Sylvie Escolano (France) ; Eero Poukka (Finlande) ; Jeffrey C. Kwong (Ontario, Canada) ; Kristine Macartney (Nouvelle-Galles du Sud, Australie) ; Jim Buttery (Victoria, Australie) ; Monika Naus (Colombie-Britannique, Canada) ; Zoe Grange (Écosse) ; et Helen Petousis-Harris (Nouvelle-Zélande).
Les personnes suivantes ont contribué en tant qu’enquêteurs du site GVDN : Gonzalo Sepulveda et Aishwarya Shetty (Victoria, Australie) ; Alexis Pillsbury (Nouvelle-Galles du Sud, Australie) ; Christopher Sullivan (Écosse) ; Naveed Zaeema (Colombie-Britannique, Canada) ; Norberto Giglio (Argentine) ; Jori Perälä (Finlande) ; Sharifa Nasreen (Ontario, Canada) ; Han Lu (Nouvelle-Zélande).
Annexe A. Matériel supplémentaire
Voici les données supplémentaires à cet article :
Télécharger : Télécharger le document Word (131 Ko)
Données supplémentaires 1 .
Disponibilité des données
Les auteurs n’ont pas l’autorisation de partager les données.
Références
- [1] Organisation mondiale de la Santé. Allocution d’ouverture du Directeur général de l’OMS lors de la conférence de presse sur la COVID-19 – 11 mars 2020. https://www.who.int/director-general/speeches/detail/who-director-general-s-opening-remarks-at-the-media-briefing-on-covid-19—11-march-2020
(consulté le 13 octobre 2023).
Notre monde en données. Vaccinations contre le coronavirus (COVID-19) – Notre monde en données 2023. https://ourworldindata.org/covid-vaccinations
(consulté le 13 octobre 2023).
Plateforme de sécurité pour les vaccins émergents S. D2.3 Liste prioritaire des effets indésirables présentant un intérêt particulier : COVID-19. Brighton Collaboration ; 2020. Disponible sur : https://zenodo.org/records/6656179#.Y-0yxuyZOnN
.
MDX van der Boom , R. van Eekeren , FPAM van Hunsel
Analyse des observations supérieures aux attentes comme méthode supplémentaire de détection des signaux de pharmacovigilance dans les rapports spontanés d’événements indésirables à grande échelle
Pharmacoépidémiologie des médicaments sûrs 32 ( 2023 ) , pp. , , 783-794 10.1002 /pds.5610 Afficher dans Scopus Google Scholar [5]
O. Mahaux , V. Bauchau , L. Van Holle
Considérations pharmacoépidémiologiques dans les analyses de la relation entre les valeurs observées et les valeurs attendues pour les vaccins
Pharmacoépidémiologie Drug Saf , 25 ( 2016 ) , p. 215 , 10.1002/PDS.3918 Afficher dans Scopus Google Scholar [6]
R. Li , B. Stewart , E. Weintraub
Évaluation de l’efficacité et de la puissance statistique des séries de cas autocontrôlées et des modèles d’intervalles de risque autocontrôlés dans la sécurité des vaccins
J Biopharm Stat , 26 ( 2016 ) , pp. 686 – 693 , 10.1080/10543406.2015.1052819 Afficher dans Scopus Google Scholar [7]
A. Pottegård , LC Lund , Ø. Karlstad , J. Dahl , M. Andersen , J. Hallas , et al.
Événements artériels, thromboembolie veineuse, thrombocytopénie et saignements après vaccination avec Oxford-AstraZeneca ChAdOx1-S au Danemark et en Norvège : étude de cohorte basée sur la population
BMJ , 373 ( 2021 ) , Article n1114 , 10.1136/bmj.n1114 Afficher dans Scopus Google Scholar [8]
Agence européenne des médicaments. Rapport d’évaluation des signaux sur les événements emboliques et thrombotiques (SMQ) avec le vaccin contre la COVID-19 (ChAdOx1-S [recombinant])-Vaxzevria (anciennement vaccin AstraZeneca contre la COVID-19) (autres vaccins viraux). 2021.
Réseau mondial de données sur les vaccins. Analyses des effets indésirables observés et attendus des vaccins contre la COVID-19 d’intérêt particulier. Version 1.4. Auckland (NZ) : Réseau mondial de données sur les vaccins ; 2022. Disponible sur : https://www.globalvaccinedatanetwork.org/sites/globalvaccinedatanetwork.org/files/2024-01/GVDN-observed-vs.-expected-analyses-of-COVID-19-vaccine-AESI-V1.4.pdf
.
Réseau mondial de données sur les vaccins. Sécurité mondiale des vaccins contre la COVID-19 (GCoVS). Auckland (NZ) : Réseau mondial de données sur les vaccins ; 2022 [consulté le 13 octobre 2023]. Disponible sur : https://www.globalvaccinedatanetwork.org/global-covid-vaccine-safety-gcovs
.
Réseau mondial de données sur les vaccins. Auckland (NZ) : Réseau mondial de données sur les vaccins ; 2023 [consulté le 13 octobre 2023]. Disponible sur : https://www.globalvaccinedatanetwork.org/
.
Réseau mondial de données sur les vaccins. GVDN : Tableau de bord des données observées et attendues (OE). Auckland (NZ) : Réseau mondial de données sur les vaccins ; 2023 [mis à jour le 8 décembre 2023 ; cité le 13 décembre 2023]. Disponible sur : www.globalvaccinedatanetwork.org/Data-Dashboards
.
A. Phillips , Y. Jiang , D. Walsh , N. Andrews , M. Artama , H. Clothier , et al.
Taux de référence des événements indésirables présentant un intérêt particulier pour les vaccins contre la COVID-19 : une analyse multinationale du Global Vaccine Data Network (GVDN)
Vaccin , 41 ( 2023 ) , pp. 6227 – 6238 , 10.1016/J.VACCINE.2023.08.079 Afficher le PDF Afficher l’article Afficher dans Scopus Google Scholar [14]
KE Hanson , K. Goddard , N. Lewis , B. Fireman , TR Myers , N. Bakshi et al.
Incidence du syndrome de Guillain-Barré après la vaccination contre la COVID-19 dans les données de sécurité des vaccins
JAMA Network Open , 5 ( 2022 ) , article E228879 , 10.1001/JAMANETWORKOPEN.2022.8879 Afficher dans Scopus Google Scholar [15]
Organisation mondiale de la Santé. Déclaration du sous-comité COVID-19 du Comité consultatif mondial de l’OMS sur la sécurité des vaccins (GACVS) concernant les cas de syndrome de Guillain-Barré (SGB) signalés après l’administration de vaccins à vecteur adénoviral contre la COVID-19. nd https://www.who.int/news/item/26-07-2021-statement-of-the-who-gacvs-covid-19-subcommittee-on-gbs
(consulté le 23 octobre 2023).
RJ Keizer , ADR Huitema , JHM Schellens , JH Beijnen
Pharmacocinétique clinique des anticorps monoclonaux thérapeutiques
Clin Pharmacokinet , 49 ( 2010 ) , pp. 493 – 507 , 10.2165/11531280-000000000-00000 Afficher dans Scopus Google Scholar [17]
Organisation mondiale de la Santé. Examen par le Comité consultatif mondial sur la sécurité des vaccins (GACVS) des dernières preuves d’effets indésirables rares de coagulation sanguine liés au vaccin d’AstraZeneca contre la COVID-19 (Vaxzevria et Covishield). Consulté le 23 octobre 2023. https://www.who.int/news/item/16-04-2021-global-advisory-committee-on-vaccine-safety-(gacvs)-review-of-latest-evidence-of-rare-adverse-blood-coagulation-events-with-astrazeneca-covid-19-vaccine-(vaxzevria-and-covishield)
.
E. Burn , X. Li , K. Kostka , H. M. Stewart , C. Reich , S. Seager , et al.
Taux de base de cinq syndromes de thrombose avec thrombocytopénie présentant un intérêt particulier pour la surveillance de la sécurité des vaccins contre la COVID-19 : incidence entre 2017 et 2019 et profils de patients de 38,6 millions de personnes dans six pays européens
Pharmacoépidémiologie des médicaments sûrs , 31 ( 2022 ) , pp. , 495-510 10.1002 / PDS.5419 Afficher dans Scopus Google Scholar [19]
A. Greinacher , T. Thiele , T. E. Warkentin , K. Weisser , P. A. Kyrle , S. Eichinger
Thrombocytopénie thrombotique après vaccination contre ChAdOx1 nCov-19
N Engl J Med , 384 ( 2021 ) , pp. 2092 – 2101 , 10.1056/NEJMOA2104840/SUPPL_FILE/NEJMOA2104840_DISCLOSURES.PDF Afficher dans Scopus Google Scholar [20]
A. Hviid , J.V. Hansen , E.M. Thiesson , J. Wohlfahrt
Association de la vaccination contre la COVID-19 par AZD1222 et BNT162b2 avec des événements thromboemboliques et thrombocytopéniques chez le personnel de première ligne : une étude de cohorte rétrospective
Ann Intern Med , 175 ( 2022 ) , pp. 541 – 546 , 10.7326/M21-2452 Afficher dans Scopus Google Scholar [21]
Organisation mondiale de la Santé. Sous-comité COVID-19 du Comité consultatif mondial de la sécurité des vaccins (GACVS) de l’OMS : orientations actualisées concernant les myocardites et péricardites signalées avec les vaccins à ARNm contre la COVID-19. Consulté le 23 octobre 2023. https://www.who.int/news/item/09-07-2021-gacvs-guidance-myocarditis-pericarditis-covid-19-mrna-vaccines
.
Ø. Karlstad , P. Hovi , A. Husby , T. Härkänen , R. M. Selmer , N. Pihlström , et al.
Vaccination contre le SRAS-CoV-2 et myocardite dans une étude de cohorte nordique portant sur 23 millions d’habitants
JAMA Cardiol , 7 ( 2022 ) , pp. 600 – 612 , 10.1001/JAMACARDIO.2022.0583 Afficher dans Scopus Google Scholar [23]
JW Gargano , M. Wallace , SC Hadler , G. Langley , JR Su , ME Oster , et al.
Utilisation du vaccin à ARNm contre la COVID-19 après des cas de myocardite chez des personnes vaccinées : mise à jour du comité consultatif sur les pratiques de vaccination — États-Unis, juin 2021
MMWR Morb Mortal Wkly Rep , 70 ( 2021 ) pp 977-982 . ,
10.15585/MMWR.MM7027E2 Crossref Afficher dans Scopus Google Scholar [24]
M. Atzenhoffer , M. Auffret , A. Pegat , K. Masmoudi , C. Khouri , B. Bertin , et al.
Syndrome de Guillain-Barré associé aux vaccins contre la COVID-19 : une perspective à partir des données de rapports spontanés
Clin Drug Investig , 42 ( 2022 ) , p. 581 , 10.1007/S40261-022-01164-4 Afficher dans Scopus Google Scholar [25]
M. Otero-Losada , N. Petrovsky , A. Alami , J.A. Crispo , D. Mattison , F. Capani , et al.
Analyse de disproportionnalité des effets indésirables neurologiques et psychiatriques des vaccins ChAdOx1 (Oxford-AstraZeneca) et BNT162b2 (Pfizer-BioNTech) contre la COVID-19 au Royaume-Uni
Avis d’expert Drug Saf , 22 ( 2023 ) , pp. 343 – 349 , 10.1080/14740338.2022.2120607 Afficher dans Scopus Google Scholar [26]
JL Walker , A. Schultze , J. Tazare , A. Tamborska , B. Singh , K. Donegan et al.
Sécurité de la vaccination contre la COVID-19 et événements neurologiques aigus : une série de cas autocontrôlés en Angleterre utilisant la plateforme OpenSAFELY
Vaccin , 40 ( 2022 ) , pp. 4479 – 4487 , 10.1016/J.VACCINE.2022.06.010 Afficher le PDF Afficher l’article Afficher dans Scopus Google Scholar [27]
M. Patone , L. Handunnetthi , D. Saatci , J. Pan , S.V. Katikireddi , S. Razvi , et al.
Complications neurologiques après la première dose de vaccins contre la COVID-19 et l’infection par le SRAS-CoV-2
Nat Med , 27 ( 2021 ) , p. 2144 , 10.1038/S41591-021-01556-7 Afficher dans Scopus Google Scholar [28]
X. Li , B. Raventós , E. Roel , A. Pistillo , E. Martinez-Hernandez , A. Delmestri , et al.
Association entre la vaccination contre la covid-19, l’infection par le SRAS-CoV-2 et le risque d’événements neurologiques à médiation immunitaire : analyse de cohorte basée sur la population et analyse de séries de cas autocontrôlées
BMJ ( 2022 ) , p. 376 , 10.1136/BMJ-2021-068373
Agence européenne des médicaments. Vaxzevria (anciennement vaccin AstraZeneca contre la COVID-19) | Agence européenne des médicaments. Consulté le 26 octobre 2023. https://www.ema.europa.eu/en/medicines/human/EPAR/vaxzevria#product-information-section
.
Rapport hebdomadaire sur la sécurité du vaccin contre la COVID-19 – 09-12-2021 | Therapeutic Goods Administration (TGA). Consulté le 5 décembre 2023. https://www.tga.gov.au/news/covid-19-vaccine-safety-reports/covid-19-vaccine-weekly-safety-report-09-12-2021#section-1298
.
J.B. Schulz , P. Berlit , HC Diener , J. Gerloff , A. Greinacher , J. Klein , et al.
Thrombose veineuse cérébrale associée au vaccin contre la COVID-19 en Allemagne
Ann Neurol , 90 ( 2021 ) , pp. 627 – 639 , 10.1002/ANA.26172 Afficher dans Scopus Google Scholar [32]
Andrews NJ, Stowe J, Ramsay ME, Miller E. Risque d’événements thrombotiques veineux et de thrombocytopénie sur des périodes séquentielles après les vaccins ChAdOx1 et BNT162b2 contre la COVID-19 : une étude de cohorte nationale en Angleterre. Lancet Reg Heal Eur 2022 ; 13. doi : 10.1016/J.LANEPE.2021.100260.
SF Gordon , HJ Clothier , H. Morgan , JP Buttery , LK Phuong , P. Monagle , et al.
Thrombocytopénie immunitaire après immunisation avec le vaccin Vaxzevria ChadOx1-S (AstraZeneca), Victoria
Vaccin Australie , 39 ( 2021 ) , pp. , 7052-7057 10.1016 / J.VACCINE.2021.10.030 Afficher le PDF Afficher l’article Afficher dans Scopus Google Scholar [34]
SA Buchan , CY Seo , C. Johnson , S. Alley , JC Kwong , S. Nasreen , et al.
Épidémiologie de la myocardite et de la péricardite après vaccination par ARNm, selon le produit vaccinal, le calendrier et l’intervalle interdose chez les adolescents et les adultes en Ontario, au Canada
JAMA Network Open , 5 ( 2022 ) , article E2218505 , 10.1001/JAMANETWORKOPEN.2022.18505 Afficher dans Scopus Google Scholar [35]
Z. Naveed , J. Li , M. Spencer , J. Wilton , M. Naus , HAV García , et al.
Taux observés et attendus de myocardite après la vaccination contre le SRAS-CoV-2 : une étude de cohorte basée sur la population
CMAJ , 194 ( 2022 ) , pp. 1529 – 1536 , 10.1503/CMAJ.220676 Afficher dans Scopus Google Scholar [36]
Z. Naveed , J. Li , J. Wilton , M. Spencer , M. Naus , HA Velásquez García et al.
Risque comparatif de myocardite/péricardite après la deuxième dose des vaccins contre les coronavirus BNT162b2 et mRNA-1273
J Am Coll Cardiol , 80 ( 2022 ) , pp. 1900 – 1908 , 10.1016/J.JACC.2022.08.799 Afficher le PDF Afficher l’article Afficher dans Scopus Google Scholar [37]
M. Patone , XW Mei , L. Handunnetthi , S. Dixon , F. Zaccardi , M. Shankar-Hari , et al.
Risques de myocardite, de péricardite et d’arythmies cardiaques associés à la vaccination contre la COVID-19 ou à l’infection par le SRAS-CoV-2
Nat Med , 28 ( 2021 ) , pp. 410 – 422 , 10.1038/s41591-021-01630-0
A. Alami , D. Krewski , N. Farhat , D. Mattison , K. Wilson , CA Gravel , et al.
Risque de myocardite et de péricardite dans les populations vaccinées et non vaccinées contre la COVID-19 par ARNm : revue systématique et méta-analyse
BMJ Open , 13 ( 2023 ) , article e065687 , 10.1136/BMJOPEN-2022-065687 Afficher dans Scopus Google Scholar [39]
Rapport sur la sécurité du vaccin contre la COVID-19 – 13-07-2023 | Therapeutic Goods Administration (TGA) et https://www.tga.gov.au/news/covid-19-vaccine-safety-reports/covid-19-vaccine-safety-report-13-07-2023#myocarditis-and-pericarditis-after-covid19-vaccination
(consulté le 5 décembre 2023).
Myocardite et péricardite après vaccination à ARNm contre la COVID-19 | CDC et https://www.cdc.gov/coronavirus/2019-ncov/vaccines/safety/myocarditis.html
(consulté le 5 décembre 2023).
K. Brock , SC Reyes , C. Conner , N. Gillson , M. Weiss , O. Elfituri , et al.
Maladie de type encéphalomyélite aiguë disséminée (ADEM) chez un patient pédiatrique après vaccination contre la COVID-19
BJR | Case Rep , 9 ( 2023 ) , 10.1259/BJRCR.20220097
S.V. Nimkar , P. Yelne , SA Gaidhane , S. Kumar , S. Acharya , RR Gemnani
Encéphalomyélite aiguë disséminée mortelle après vaccination contre la COVID-19 : un cas rare
Cureus , 14 ( 2022 ) , 10.7759/CUREUS.31810
F. Permezel , B. Borojevic , S. Lau , HH de Boer
Encéphalomyélite aiguë disséminée (ADEM) suite à la récente vaccination contre la COVID-19 par Oxford/AstraZeneca
Forensic Sci Med Pathol , 18 ( 2022 ) , pp. 74 – 79 , 10.1007/S12024-021-00440-7 Afficher dans Scopus Google Scholar [44]
S. Khan , S. Khan , Z. Waqar , H. Mobeen , N. Khan , M. Hassan
Encéphalomyélite aiguë disséminée (ADEM) associée au vaccin post-moderne – un rapport de cas
Pak J Neurol Sci , 17 ( 2022 )
Agence européenne des médicaments. Mise à jour sur la sécurité des vaccins contre la COVID-19 ; 2021. https://www.ema.europa.eu/en/documents/covid-19-vaccine-safety-update/covid-19-vaccine-safety-update-vaxzevria-previously-covid-19-vaccine-astrazeneca-18-june-2021_en.pdf
.
J.A. Frontera , A.A. Tamborska , M.F. Doheim , D. Garcia-Azorin , H. Gezegen , A. Guekht , et al.
Événements neurologiques signalés après l’administration des vaccins contre la COVID-19 : une analyse du système de déclaration des événements indésirables liés aux vaccins