Source
Pour télécharger l’article
Par Maurizio Federico
Centre national pour la santé mondiale, Istituto Superiore di Sanità, 00161 Rome, Italie
Vaccins 2024 , 12 (11), 1281 ; https://doi.org/10.3390/vaccines12111281
Soumission reçue : 11 octobre 2024 / Révisé : 11 novembre 2024 / Accepté : 13 novembre 2024 / Publié : 14 novembre 2024
(Cet article appartient au numéro spécial Efficacité, immunogénicité et sécurité des vaccins contre la COVID-19 et Stratégies de vaccination contre la COVID-19 )
Abstrait
L’action des vaccins à base d’ARNm nécessite l’expression de l’antigène dans des cellules ciblées par des complexes lipidiques nanoparticules-ARNm. Lorsque l’antigène vaccinal n’est pas entièrement retenu par les cellules productrices, sa diffusion locale et systémique peut avoir des conséquences dépendant à la fois des niveaux d’expression de l’antigène et de son activité biologique. Une particularité des vaccins COVID-19 à base d’ARNm réside dans les quantités extraordinairement élevées d’antigène Spike exprimées par les cellules cibles. De plus, le vaccin Spike peut être excrété et se lier aux récepteurs cellulaires ACE-2, induisant ainsi des réponses d’importance pathogénétique, notamment la libération de facteurs solubles qui, à leur tour, peuvent déréguler des processus immunologiques clés. De plus, les réponses immunitaires circulatoires déclenchées par le vaccin Spike sont assez puissantes et peuvent conduire à une liaison croisée efficace des anticorps anti-Spike, ainsi qu’à l’émergence d’anticorps à la fois auto- et anti-idiotypes. Dans cet article, les inconvénients immunologiques de la forte efficacité de la traduction de l’ARNm associé aux vaccins contre la COVID-19 sont discutés ainsi que les arguments soutenant l’idée que la plupart d’entre eux peuvent être évités avec l’avènement des vaccins muqueux contre la COVID-19 de nouvelle génération. 19 vaccins.
Mots-clés :
Vaccins à ARNm contre la COVID-19 ; Pointe du SRAS-CoV-2 ; vaccins muqueux ; ACE-2 ; auto-immunité
1. Introduction
Les vaccins à base d’ARNm contre la COVID-19 ont été distribués à de nombreuses personnes dans leurs versions originales et actuelles mises à jour. En outre, la technologie de l’ARNm constitue la base de vaccins expérimentaux supplémentaires ainsi que de la dernière génération d’immunothérapies anticancéreuses. Il est donc obligatoire d’identifier, de surveiller et d’analyser en profondeur les événements inattendus les plus pertinents que cette technologie peut produire chez l’homme, même si ceux-ci se produisent rarement.
Plusieurs caractéristiques distinguent les vaccins contre la COVID-19 à base d’ARNm des vaccins « traditionnels » basés sur des virus atténués/inactivés, des produits de sous-unités ou des produits recombinants, qui ont été si utiles pour l’élimination/le confinement de plusieurs maladies infectieuses. Premièrement, la formulation du vaccin comprend des nanoparticules lipidiques (LNP) complexées avec des molécules d’ARNm produites par le processus de transcription in vitro. Deuxièmement, l’immunogène ne fait pas partie de la formulation du vaccin, mais il devrait être synthétisé par les cellules internalisant les complexes ARNm/LNP. Cette preuve justifie la définition plus appropriée du promédicament (conçu comme une substance pharmacologiquement inactive qui est convertie dans le corps en un médicament pharmacologiquement actif) plutôt que du vaccin [ 1 ]. Troisièmement, l’immunogène (c’est-à-dire la protéine virale Spike) est synthétisé par les cellules cibles à des niveaux très élevés et persiste dans le temps [ 2 ]. Quatrièmement, l’immunogène reconnaît, se lie et active un récepteur cellulaire de signalisation répandu, à savoir l’enzyme de conversion de l’angiotensine (ACE)-2, et est stabilisé dans sa conformation de préfusion par deux mutations consécutives en proline aux positions d’acides aminés 986 et 987. qui n’ont pas d’impact négatif sur la liaison/activation de l’ACE-2. Par conséquent, l’abondance, la diffusion, la persistance, l’activité biologique et la stabilité de l’immunogène sont des points clés distinguant les vaccins COVID-19 à base d’ARNm.
Dans cet article, les conséquences les plus pertinentes de la surproduction de l’antigène Spike après la vaccination contre le COVID-19 à base d’ARNm et de la réponse immunitaire circulatoire plutôt puissante évoquée sont discutées. Une image complète de toutes les préoccupations possibles serait d’une utilité majeure pour le développement de vaccins plus sûrs et plus ciblés contre le SRAS-CoV-2 et d’autres agents infectieux aéroportés. Parmi ceux-ci, les vaccins muqueux méritent une certaine attention compte tenu de leur action au point d’entrée du virus et de l’absence d’effets systémiques indésirables.
2. Niveaux élevés et persistants de pic de circulation après la vaccination
Les complexes ARNm/nanoparticules lipidiques (LNP) peuvent pénétrer dans n’importe quel type de cellule. L’injection dans le muscle deltoïde favorise leur entrée dans les cellules musculaires ; cependant, l’inflammation modérée induite par certains composants lipidiques [ 3 ] peut attirer des cellules professionnelles présentatrices d’antigène (APC) vers le site d’injection. Les APC peuvent ingérer les LNP, subir une activation et migrer vers les ganglions lymphatiques [ 4 ]. De plus, des quantités non quantifiables de complexes ARNm/LNP injectés échappent à l’internalisation cellulaire au site d’injection, entrant ainsi en circulation. De manière cohérente, les études de biodistribution réalisées par un fabricant de vaccins à ARNm COVID-19 ont mis en évidence la diffusion potentielle des LNP injectés par voie intramusculaire dans presque tous les tissus [ 5 ].
L’ARNm et le vaccin Spike persistent dans l’organisme longtemps après la vaccination. Une étude réalisée sur des échantillons autooptiques de patients après vaccination contre le COVID-19 a démontré la persistance de l’ARNm du vaccin dans les ganglions lymphatiques axillaires bilatéraux jusqu’à 30 jours après la vaccination [ 6 ]. Notamment, l’ARNm du vaccin a également été trouvé dans les ventricules cardiaques jusqu’à 20 jours après l’injection, et sa présence était corrélée à des lésions myocardiques associées à un nombre anormalement élevé de macrophages myocardiques. Dans une autre étude, l’ARNm du vaccin a été trouvé jusqu’à 60 jours après la deuxième dose dans des biopsies des ganglions lymphatiques axillaires homolatéraux [ 2 ].
Une partie du Spike exprimé de manière intracellulaire reste exposée sur la membrane plasmique des cellules cibles sous sa forme trimérique, tandis qu’une fraction cohérente de celui-ci peut être excrétée et circuler. En conséquence, une médiane de 47 pg/mL de Spike libre a été mesurée dans le plasma des vaccinés 1 à 2 jours après l’injection, avec des pics de 174 pg/mL [ 2 ]. Ces niveaux de Spike dans le plasma semblent étonnamment élevés, allant, par exemple, aux concentrations de cytokines inflammatoires détectées chez les sujets présentant une inflammation systémique aiguë [ 7 ]. Cette preuve est particulièrement pertinente compte tenu de la forte affinité de Spike pour ACE-2, c’est-à-dire un récepteur cellulaire répandu impliqué dans plusieurs processus physiologiques clés.
3. ACE-2 : Résumé des fonctions, de la distribution et de la signalisation lors de la liaison de pointes
ACE-2 est une protéine transmembranaire de type I longue de 805 acides aminés avec une région N-terminale extracellulaire glycosylée contenant le domaine carboxypeptidase dont la fonction consiste à éliminer les acides aminés uniques de l’extrémité C-terminale de ses substrats. ACE-2 est un régulateur clé du système rénine-angiotensine-aldostérone, qui contrôle la pression artérielle. Il catalyse la conversion de l’angiotensine I, un décapeptide, en angiotensine 1 à 9, qui peut être convertie en peptides d’angiotensine vasodilatateurs plus petits (par exemple, angiotensine 1 à 7) par l’ECA dans les poumons. L’ACE-2 se lie également à l’angiotensine II, c’est-à-dire un octapeptide généré par le clivage de l’angiotensine I piloté par l’ACE, pour produire l’angiotensine vasodilatatrice 1-7. ACE-2 est également impliqué dans la production de bradykinines, c’est-à-dire un groupe de peptides ayant de puissants effets vasodilatateurs [ 8 ].
ACE-2 est exprimé par une grande variété de cellules, notamment les entérocytes, les cardiomyocytes, les tubules rénaux, le système vasculaire et les cellules canalaires. À l’inverse, l’expression de l’ACE-2 dans les tissus respiratoires est limitée à un petit nombre de types de cellules spécialisées, c’est-à-dire les cellules alvéolaires de type II et les macrophages alvéolaires [ 9 ].
L’interaction entre l’ACE-2 et l’angiotensine II induit diverses voies de signalisation conduisant finalement à la libération de plusieurs cytokines, dont l’IL-6, le TNF-α et le TGF-β [ 10 ]. Notamment, les effets de l’interaction de l’ACE-2 avec Spike récapitulent ceux décrits pour sa liaison avec ses ligands naturels [ 11 ]. En particulier, dans les cellules endothéliales vasculaires, Spike naturel génère un bloc des fonctions mitochondriales [ 12 ]; pendant ce temps, la commutation de la signalisation dépendante de l’intégrine ⍺5β1 conduit à la translocation nucléaire de NF-κB. Ces événements induisent finalement l’expression de VCAM-1, ICAM-1, de facteurs de coagulation et la libération de cytokines inflammatoires TNFα, IL-1β et IL-6 [ 13 ]. Des mécanismes d’activation similaires ont été rapportés pour les macrophages et les cellules dendritiques [ 14 , 15 ]. Il est important de noter que Spike naturel induit dans les cellules épithéliales et endothéliales la libération de cytokine pléiotrope TGF-β [ 16 ].
4. L’axe SARS-CoV-2 Spike/ACE-2/TGF-β dans la surveillance immunitaire antitumorale et la transition épithéliale à mésenchymateuse
La liaison de Spike avec ACE-2 produit de profondes altérations de la signalisation intracellulaire avec l’activation de facteurs de transcription et la libération de plusieurs facteurs solubles. En particulier, il a été constaté que les cellules endothéliales vasculaires humaines traitées avec Spike libèrent à la fois du TGF-β1 et du TGF-β2 [ 17 ], ce qui est cohérent avec les précédentes preuves « in vivo » suggérant un rôle clé du TGF-β dans la pathogenèse du COVID-19 [ 18 , 19 ].
Le TGF-β, avec ses trois isoformes, c’est-à-dire -β1 à -β3, est un régulateur clé de la réponse immunitaire adaptative [ 20 ], agissant, par exemple, comme un inhibiteur de l’activité de présentation d’antigène dans les cellules dendritiques (DC) grâce à la régulation négative des molécules du complexe majeur d’histocompatibilité (CMH) [ 21 , 22 ] ( Figure 1 ). Il réduit également l’expression de l’IL-12 et des molécules co-stimulatrices telles que CD40 dans les macrophages et CD80, CD83 et CD86 dans les CD, dans le cadre des mécanismes de régulation de l’activation des cellules immunitaires médiées par APC [ 23 , 24 ].
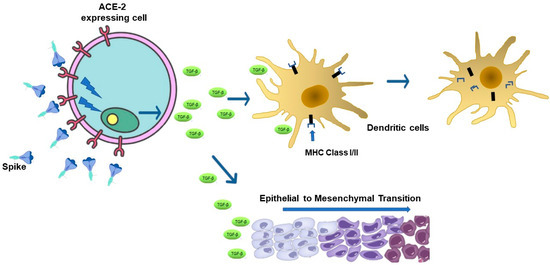
Graphique 1. Effets spectateurs de la liaison Spike/ACE-2. La protéine libre SARS-CoV-2 Spike se lie aux cellules exprimant l’ACE-2, induisant ainsi une signalisation intracellulaire, conduisant à la libération de facteurs solubles. Parmi ceux-ci, le TGF-β est connu pour réguler négativement l’activité de présentation de l’antigène dans les APC via une régulation négative du CMH de classe I/II. Le TGF-β est également un moteur majeur de la transition épithéliale-mésenchymateuse qui est à la base du développement des tumeurs solides et des métastases.
Le TGF-β peut également interférer avec les mécanismes de surveillance immunitaire contrôlant la croissance des cellules tumorales. Par exemple, le TGF-β peut induire la polarisation des macrophages de M1 (marquée par la libération de cytokines inflammatoires telles que l’IL-1β, l’IFN-γ, le TNF-α, l’IL-12 et l’IL-18) vers les macrophages M2, sécrétant cytokines anti-inflammatoires comme l’IL-1ra et l’IL-10, et caractérisées par de multiples propriétés immunosuppressives du microenvironnement tumoral [ 25 ]. D’autre part, le TGF-β est un moteur majeur de la transition épithéliale-mésenchymateuse (EMT) [ 26 ], qui est à la base du développement des tumeurs solides et des métastases. Dans ce scénario, les résultats cohérents des travaux expérimentaux de deux groupes de recherche ont soulevé l’hypothèse selon laquelle Spike naturel peut contribuer à l’EMT ( Figure 1 ). En détail, Lai et ses collègues ont fourni la preuve que la signalisation liée au TGF-β fait partie du mécanisme sous-jacent à l’acquisition d’un phénotype de type mésenchymateux de cellules cancéreuses du sein humaines exprimant Spike. Plus important encore, ils ont démontré que le nombre de métastases pulmonaires chez les souris inoculées avec des cellules cancéreuses du sein 4T1 exprimant Spike augmentait par rapport à celui induit par les cellules parentales. 27 , 28 ]. Ciszewski et ses collègues ont observé que le traitement avec Spike recombinant de type sauvage des cellules endothéliales humaines HUVEC et HMEC-1 induit la libération de TGF-β associée à la trans-différenciation cellulaire. En étudiant le mécanisme d’action sous-jacent, ils ont prouvé l’implication de l’axe ACE-2/TGF-β/MRTF (facteur de transcription lié à la myocarde)-β dans l’EMT observé. Enfin, la contribution du TGF-β dans l’EMT lié à Spike a été en outre corroborée par la démonstration que les cellules endothéliales humaines traitées par Spike n’ont pas réussi à se trans-différencier en présence d’anticorps anti-TGF-β [ 17 ].
Les résultats de ces études posent la question de savoir si Spike peut contribuer à l’EMT chez l’homme. Même si aucune donnée clinique décrivant les événements associés à ces réponses immunitaires pathologiques n’est disponible jusqu’à présent, les implications potentielles en termes de sécurité des vaccins contre la COVID-19 semblent également se manifester compte tenu des preuves selon lesquelles les ARNm/LNP peuvent pénétrer dans n’importe quel type de cellule. Par exemple, l’entrée malheureuse de complexes ARNm/LNP dans des cellules tumorales déjà émergées peut reproduire les conditions décrites par Lai et ses collègues, représentant ainsi un risque en termes de formation de métastases. D’un autre côté, des effets pathogénétiques de spectateur peuvent être induits par la production locale de fortes concentrations de Spike par des cellules normales ciblées par les ARNm/LNP et situées à proximité des cellules tumorales, comme décrit par Ciszewski et coll. Pour ces raisons, étendre les études à des systèmes cellulaires supplémentaires ainsi qu’à des modèles « in vivo » appropriés apparaît obligatoire compte tenu de la possibilité que des complexes ARNm/LNP circulent dans l’organisme après la vaccination.
5. Immunité non spécifique induite par le vaccin à ARNm COVID-19 : liaison croisée d’anticorps, autoanticorps, anticorps anti-idiotypes et changement de cadre ribosomal
Les niveaux élevés de vaccin Spike produits après l’injection sont associés à une réponse immunitaire circulatoire extraordinairement puissante, avec la production de titres élevés d’anticorps anti-Spike. D’une part, ce résultat est considéré comme un avantage en termes de protection antivirale ; d’un autre côté, cependant, une immunogénicité aussi puissante peut être associée à des effets indésirables pertinents apparaissant généralement en présence de stimuli antigéniques à la fois élevés et persistants. Ceux-ci incluent la liaison substantielle des anticorps anti-Spike réagissant de manière croisée avec les antigènes du « soi » avec l’induction de processus non physiologiques/pathogénétiques, l’émergence d’auto-anticorps et la génération d’anticorps anti-idiotypes. Ces événements ont été corrélés à l’émergence chez les vaccinées de pathologies comme la thrombocytopénie, la myocardite, divers troubles du cycle menstruel, la réémergence d’infections latentes et le syndrome vaccinal post-COVID (PCVS).
Les anticorps à réaction croisée se lient à des cibles hétérologues via le mécanisme du mimétisme moléculaire. Très probablement, des effets pathogénétiques peuvent se produire lorsque des quantités suffisantes d’entre eux se lient à des cibles moléculaires non spécifiques agissant dans des processus biologiques pertinents. Grâce à une analyse informatique du mimétisme moléculaire entre Spike et des épitopes humains connus, il a été rapporté que Spike partage des motifs linéaires immunogènes avec, entre autres, la thrombopoïétine (TQPLL) et la tropomyosine alpha-3 (ELDKY) [ 29 ]. Ces résultats semblent pertinents puisque le premier est un facteur de croissance clé nécessaire à la différenciation mégacaryocytaire et à la production de plaquettes, et le second est un composant structurel des cardiomyocytes. Dans une autre étude, il a été rapporté que Spike partage 41 déterminants immunitaires minimaux avec 27 protéines humaines spécifiques au système reproducteur féminin liées à l’ovogenèse, à la réceptivité utérine, à la décidualisation et à la placentation [ 30 ].
Des études cliniques ont fourni la preuve que l’injection de vaccins à ARNm contre la COVID-19 peut être associée à la production d’auto-anticorps, c’est-à-dire d’anticorps non anti-Spike reconnaissant les auto-antigènes, comme conséquence possible d’une dérégulation immunitaire générale. Par exemple, Xu et ses collègues [ 31 ] ont trouvé des anticorps neutralisants anti-interféron de type I chez 10 % des individus vaccinés en bonne santé, bien qu’avec une taille d’échantillon limitée. Dans une autre étude, 18 % des patients développant un PCVS produisent des auto-anticorps contre les sous-unités des neurofilaments [ 32 ]. Même si, dans certains cas, les auto-anticorps peuvent représenter des spectateurs innocents, il est encore difficile de savoir si la vaccination réactive l’auto-immunité latente préexistante ou induit la génération « de novo » d’auto-anticorps.
Le mimétisme moléculaire est également à la base des effets des anticorps anti-idiotypes ( Figure 2 ).
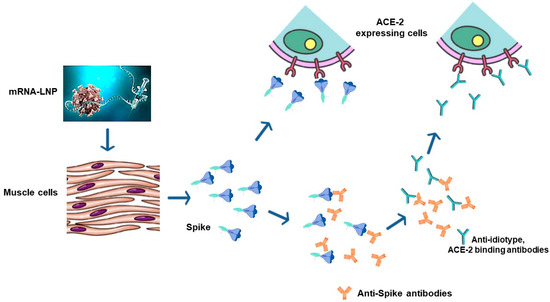
Graphique 2. Génération d’anticorps anti-idiotypes après la vaccination contre le COVID-19. Le système immunitaire peut générer des anticorps contre les séquences d’anticorps anti-Spike reconnaissant le domaine Spike liant le récepteur ACE-2 (domaine de liaison au récepteur, RBD). Grâce à un mécanisme de mimétisme moléculaire, ces anticorps (anticorps anti-idiotypes) peuvent se lier à l’ACE-2 tout comme le Spike immunogène.
Dans le cas où l’immunogène est un antigène se liant à un partenaire moléculaire, le système immunitaire peut réagir contre les séquences au sein des anticorps anti-antigènes induits qui reconnaissent la région de l’antigène qui se lie à son partenaire, par exemple dans le cas de Spike, le domaine de liaison au récepteur (RBD). Dans des conditions physiologiques, ce mécanisme contribue au contrôle de la production d’anticorps spécifiques de l’antigène. Cependant, en présence de quantités excessives d’anticorps spécifiques de l’antigène, comme dans le cas de la vaccination anti-COVID-19 à base d’ARNm, l’hyperproduction d’anticorps anti-idiotype qui en résulte peut conduire à des effets imitant ceux induits par la liaison de Spike avec ACE-2 [ 33 ]. Bellucci et ses collègues ont récemment démontré les effets secondaires associés à la production d’anticorps anti-idiotype se liant à l’ACE-2. En particulier, ils ont signalé des complications cliniques neurologiques, notamment une radiculite, une myélite et un syndrome de Guillain-Barré, chez des sujets infectés et non infectés par le SRAS-CoV-2, ayant reçu une injection de vaccins contre la COVID-19 à base d’ARNm et développant des auto-anticorps anti-ACE-2. 34 ]. Malheureusement, les autoanticorps et les anticorps anti-idiotypes devraient persister au-delà de la durée de la réponse immunitaire anti-Spike.
La découverte récente selon laquelle l’incorporation de N1-méthyl-pseudouridine à la place du résidu naturel d’uridine dans le squelette de l’ARNm associé au vaccin peut induire un décalage de cadre ribosomal +1 a ajouté une autre couche de complexité en termes de réponse immunitaire induite par le vaccin. Il a été estimé qu’environ 8 % du total des produits traduits représentent des protéines inconnues immunogènes chez l’homme [ 35 ]. Le potentiel auto-immun des produits protéiques aberrants ainsi générés représente un point supplémentaire qui doit être étudié plus en profondeur.
6. Vaccins muqueux : une alternative potentiellement exempte d’effets secondaires systémiques
Le champ de bataille du COVID-19 est le système respiratoire, où le vaccin idéal contre le COVID-19 devrait développer sa force immunologique et antivirale la plus efficace. Les données cliniques rapportées concernant les vaccins COVID-19 actuels à base d’ARNm soutiennent l’idée selon laquelle la forte réponse immunitaire circulatoire est associée à une immunité antivirale dans les zones respiratoires qui est trop limitée [ 36 ].
De la même manière que ce qui a été démontré avec les infections naturelles [ 37 ], les vaccins muqueux ont le potentiel de susciter des réponses immunitaires efficaces dans le compartiment respiratoire grâce à l’induction à la fois d’IgA dimères/sécrétoires neutralisantes dans le district oronasopharyngé [ 38 ] et de CD8 de mémoire résidente antivirale. + Lymphocytes T dans les voies respiratoires inférieures [ 39 ]. Ainsi, des vaccins muqueux efficaces ont l’avantage incomparable de bloquer la chaîne de transmission du SRAS-CoV-2 ainsi que d’autres virus aéroportés.
À l’heure actuelle, deux vaccins muqueux COVID-19 ont été approuvés et d’autres sont en expérimentation clinique [ 40 ]. Il convient de noter qu’en aucun cas ces vaccins ne devraient induire de réponses immunitaires systémiques robustes comme celles observées avec les vaccins actuels contre la COVID-19. Cependant, une immunisation systémique sous-optimale/faible ne doit pas être considérée comme un inconvénient fonctionnellement pertinent compte tenu du compartimentage du système immunitaire respiratoire [ 41 ], qui limite l’accès des IgG neutralisantes et des cellules immunitaires antivirales du district circulatoire. À l’inverse, cela représente un avantage en termes de forte réduction/absence d’effets systémiques immunologiques induits par les vaccins COVID-19 à base d’ARNm injectés par voie parentérale, y compris la production d’anticorps anti-idiotypiques circulatoires indésirables.
7. Conclusions
Plusieurs éléments de preuve expérimentaux soutiennent l’idée selon laquelle la protéine Spike est produite en abondance et persiste après la vaccination par ARNm COVID-19. Cependant, les vaccins actuels contre la COVID-19 à base d’ARNm reconnaissent une série de limitations pertinentes, notamment le déclin rapide de la réponse immunitaire, l’incapacité de développer une réponse immunitaire efficace au point d’entrée du virus et l’efficacité réduite des formulations mises à jour en raison de la phénomène de péché antigénique originel [ 42 , 43 ]. D’un autre côté, une traduction puissante de l’ARNm associée à une surproduction de Spike peut conduire à une dérégulation de la signalisation ACE-2 et de la production de cytokines, à une réaction croisée des anticorps contre des cibles moléculaires non spécifiques, à l’émersion d’anticorps auto- et anti-idiotypes et à des réponses immunitaires. d’importance incertaine contre des produits inconnus. De plus, les cytokines produites après la liaison Spike/ACE-2 peuvent influencer défavorablement le devenir des tumeurs encore « dormantes » et des pathologies auto-immunes préexistantes ainsi que des inflammations chroniques. Pour ces raisons, l’indication actuelle des vaccins à ARNm contre la COVID-19 pour la population « fragile » doit être soigneusement réévaluée à la lumière de la typologie de chaque fragilité spécifique.
Malgré l’efficacité remarquable de la production d’antigènes, des tentatives pour améliorer les performances de ces vaccins COVID-19 à base d’ARNm ont été faites dans le sens de renforcer la production de Spike grâce à l’injection parentérale de vecteurs à base d’ARNm auto-réplicatifs [ 44 ]. Notamment, le ministère japonais de la Santé a récemment approuvé un essai clinique pour tester la sécurité et l’efficacité d’un vaccin COVID-19 basé sur cette technologie [ 45 ]. Ce choix semble véritablement discutable étant donné les lacunes décrites ci-dessus induites par la production excessive et la persistance de Spike circulatoire dictées par les vaccins COVID-19 actuels à base d’ARNm. Dans ce scénario, l’augmentation des quantités et de la persistance de Spike en circulation devrait exacerber les effets secondaires à la fois cellulaires et immunologiques, mais sans agir sur la limitation fonctionnelle la plus importante de ces vaccins, à savoir leur incapacité à susciter une immunité neutralisante dans les voies respiratoires. à la compartimentation immunitaire du système respiratoire. De plus, un stimulus immunogène trop puissant et persistant est connu pour induire une tolérance immunologique, comme cela a également été rapporté dans quelques articles sur les vaccins actuels contre le COVID-19. 46 , 47 ].
À l’inverse, une voie plus plausible à suivre est représentée par le développement de vaccins muqueux efficaces [ 48 ] compte tenu de leur capacité à agir au point d’entrée du virus et à éviter la plupart des effets secondaires systémiques observés dans les vaccins à ARNm COVID-19 injectés par voie intramusculaire. .
La technologie basée sur l’ARNm suscite actuellement l’intérêt de nombreux scientifiques du monde entier. Dans le cas des vaccins contre la COVID-19, il semble plus que raisonnable qu’une charge d’enquête adéquate soit concentrée sur l’identification et l’analyse d’événements inattendus, dans le but évident de rendre cette stratégie prophylactique plus sûre et adaptée à une utilisation dans un grand nombre de personnes. de personnes en bonne santé.
Financement
Ce travail a été soutenu par la subvention RiPrEI, no. Rip 001, du ministère de la Santé, Rome, Italie.
Déclaration du comité d’examen institutionnel
Sans objet.
Déclaration de consentement éclairé
Sans objet.
Déclaration de disponibilité des données
Aucune nouvelle donnée n’a été créée.
Remerciements
Je remercie Rosangela Duranti et Federica Magnani pour leur assistance en matière de secrétariat.
Conflits d’intérêts
L’auteur ne déclare aucun conflit d’intérêts.
Références
- Cosentino, M. ; Marino, F. Comprendre la pharmacologie des vaccins à ARNm contre la COVID-19 : jouer aux dés avec le Spike ? Int. J. Mol. Sci. 2022 , 23 , 10881. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Röltgen, K. ; Nielsen, SCA; Silva, O. ; Younes, SF ; Zaslavski, M. ; Costales, C. ; Yang, F. ; Wirz, OF; Solis, D. ; Oh, RA ; et coll. Empreinte immunitaire, étendue de la reconnaissance des variantes et réponse du centre germinal dans l’infection et la vaccination humaines par le SRAS-CoV-2. Cellule 2022 , 185 , 1025-1040.e14. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Moghimi, SM; Simberg, D. Préoccupations pro-inflammatoires liées aux nanoparticules lipidiques. Mol. Là. 2022 , 30 , 2109-2110. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Lindsay, KE ; Bhosle, SM; Zurla, C. ; Beyersdorf, J. ; Rogers, KA ; Vanover, D. ; Xiao, P. ; Araínga, M. ; Shirreff, LM; Pitard, B. ; et coll. Visualisation des premiers événements de l’administration de vaccins à ARNm chez des primates non humains via PET-CT et imagerie proche infrarouge. Nat. Bioméde. Ing. 2019 , 3 , 371-380. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- EMA. Rapport d’évaluation Nom commun Comirnaty : Vaccin à ARNm contre la COVID-19 (nucléoside modifié). 2021. Disponible en ligne : https://www.ema.europa.eu/en/documents/assessment-report/comirnaty-epar-public-assessment-report_en.pdf (consulté le 5 septembre 2024).
- Krauson, AJ; Casimero, CVF ; Siddiquee, Z. ; Stone, JR Durée de la persistance du vaccin à ARNm du SRAS-CoV-2 et facteurs associés à l’atteinte cardiaque chez les patients récemment vaccinés. npj Vaccines 2023 , 8 , 141. [ Google Scholar ] [ CrossRef ]
- Wong, CK; Lam, CWK; Wu, AKL; IP, WK ; Lee, NLS ; Chan, IHS; Allumé, LCW ; Hui, DSC; Chan, MHM; Chung, CSS; et coll. Cytokines inflammatoires plasmatiques et chimiokines dans le syndrome respiratoire aigu sévère. Clin. Exp. Immunol. 2004 , 136 , 95-103. [ Google Scholar ] [ CrossRef ]
- Kuba, K. ; Yamaguchi, T. ; Penninger, JM Enzyme de conversion de l’angiotensine 2 (ACE2) dans la pathogenèse du SDRA dans le COVID-19. Devant. Immunol. 2021 , 12 , 732690. [ Google Scholar ] [ CrossRef ]
- Hikmet, F. ; Méar, L. ; Edvinsson, Å.; Micke, P. ; Uhlén, M. ; Lindskog, C. Le profil d’expression protéique de l’ACE2 dans les tissus humains. Mol. Système. Biol. 2020 , 16 , e9610. [ Google Scholar ] [ CrossRef ]
- Santos, RAS ; Sampaio, WO; Alzamora, Californie ; Motta-Santos, D. ; Alénine, N. ; Bader, M. ; Campagnole-Santos, MJ L’axe ACE2/Angiotensine-(1-7)/MAS du système rénine-angiotensine : Focus sur l’angiotensine-(1-7). Physiol. Rév.2018 98 , , 505-553. [ Google Scholar ] [ CrossRef ]
- Ni, W. ; Yang, X. ; Yang, D. ; Bao, J. ; Li, R. ; Xiao, Y. ; Hou, C. ; Wang, H. ; Liu, J. ; Yang, D. ; et coll. Rôle de l’enzyme de conversion de l’angiotensine 2 (ACE2) dans le COVID-19. Critique. Soins 2020 , 24 , 422. [ Google Scholar ] [ CrossRef ]
- Lei, Y. ; Zhang, J. ; Schiavon, CR; Lui, M. ; Chen, L. ; Shen, H. ; Zhang, Y. ; Yin, Q. ; Cho, Y. ; Andrade, L. ; et coll. La protéine Spike du SRAS-CoV-2 altère la fonction endothéliale via une régulation négative de l’ACE 2. Circ. Rien. 2021 , 128 , 1323-1326. [ Google Scholar ] [ CrossRef [ PubMed ]
- Robles, JP; Zamora, M. ; Adan-Castro, E. ; Siqueiros-Marquez, L. ; de l’Escalier, GM ; Clapp, C. La protéine Spike du SRAS-CoV-2 induit une inflammation endothéliale via la signalisation de l’intégrine A5β1 et NF-ΚB. J. Biol. Chimique. 2022 , 298 , 101695. [ Google Scholar ] [ CrossRef [ PubMed ]
- Barhoumi, T. ; Alghanem, B. ; Shaiba, H. ; Mansour, FA; Alamri, HS; Akiel, MA ; Alroqi, F. ; Boudjelal, M. Apoptose induite par les protéines de pointe du coronavirus SARS-CoV-2, réponses au stress inflammatoire et oxydatif dans les macrophages de type THP-1 : rôle potentiel de l’inhibiteur de l’enzyme de conversion de l’angiotensine (périndopril). Devant. Immunol. 2021 , 12 , 728896. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Winheim, E. ; Rinke, L. ; Lutz, K. ; Reischer, A. ; Leutbecher, A. ; Wolfram, L. ; Rausch, L. ; Kranich, J. ; Wratil, PR ; Huber, JE ; et coll. Fonction altérée et régénération retardée des cellules dendritiques dans le COVID-19. Pathog PLoS. 2021 , 17 , e1009742. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Gracie, IP ; Lai, LYS ; Newsome, signalisation cellulaire TP par la protéine Spike du SRAS-CoV-2. Microbiol. Aust. 2024 , 45 , 13-17. [ Google Scholar ] [ CrossRef ]
- Ciszewski, WM; Woźniak, LA ; Sobierajska, K. Divers rôles des protéines de pointe et de nucléocapside du SRAS-CoV-2 dans la stimulation de l’EndMT via l’axe TGF-β-MRTF inhibé par l’aspirine. Cellule commune. Signal 2024 , 22 , 296. [ Google Scholar ] [ CrossRef ]
- Biering, SB ; Gomes de Sousa, FT; Tjang, LV ; Pahmeier, F. ; Zhu, C. ; Ruan, R. ; Blanc, SF; Patel, TS ; Worthington, CM ; Glasner, DR ; et coll. Le pic du SRAS-CoV-2 déclenche un dysfonctionnement de la barrière et une fuite vasculaire via les intégrines et la signalisation TGF-β. Nat. Comm. 2022 , 13 , 7630. [ Google Scholar ] [ CrossRef ]
- Carvacho, I. ; Piesche, M. Intégrines de liaison au RGD et TGF-β dans les infections par le SRAS-CoV-2 : de nouvelles cibles pour traiter les patients atteints de COVID-19 ? Clin. Trad. Immunol. 2021 , 10 , e1240. [ Google Scholar ] [ CrossRef ]
- Deng, Z. ; Fan, T. ; Xiao, C. ; Tian, H. ; Zheng, Y. ; Li, C. ; Lui, J. Signalisation TGF-β dans la santé, la maladie et la thérapeutique. Transduction de signal. Cible. Là. 2024 , 9 , 61. [ Google Scholar ] [ CrossRef ]
- Batlle, E. ; Massagué, J. Transformation de la signalisation du facteur de croissance-β dans l’immunité et le cancer. Immunité 2019 , 50 , 924-940. [ Google Scholar ] CrossRef [
- Nandan, D. ; Reiner, NE TGF-Beta atténue le transactivateur de classe II et révèle une voie accessoire de l’action IFN-Gamma. J. Immunol. 1997 , 158 , 1095-1101. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Geissmann, F. ; Révy, P. ; Regnault, A. ; Lepelletier, Y. ; Dy, M. ; Brousse, N. ; Amigorena, S. ; Hermine, O. ; Durandy, A. TGF-Beta 1 empêche la maturation non apparentée des cellules dendritiques de Langerhans humaines. J. Immunol. 1999 , 162 , 4567-4575. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Takeuchi, M. ; Alard, P. ; Streilein, JW TGF-Beta favorise la déviation immunitaire en modifiant les signaux accessoires des cellules présentatrices d’antigène. J. Immunol. 1998 , 160 , 1589-1597. [ Google Scholar ] [ CrossRef ]
- Mantovani, A. ; Sozzani, S. ; Locati, M. ; Allavena, P. ; Sica, A. Polarisation des macrophages : macrophages associés aux tumeurs comme paradigme pour les phagocytes mononucléaires M2 polarisés. Tendances Immunol. 2002 , 23 , 549-555. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Angioni, R. ; Sánchez-Rodríguez, R. ; Viole, A. ; Molon, B. TGF-β dans le cancer : moteur métabolique de la diaphonie tolérogène dans le microenvironnement tumoral. Cancers 2021 , 13 , 401. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Lai, Y.-J.; Chao, CH ; Liao, CC-C.; Lee, TA ; Hsu, J.-M. ; Chou, WC; Wang, J. ; Huang, HC ; Chang, S.-J. ; Lin, Y.-L.; et coll. La transition épithéliale-mésenchymateuse induite par le SRAS-CoV-2 a nécessité une régulation transcriptionnelle positive de l’escargot. Suis. J. Cancer Rés. 2021 , 11 , 2278-2290. [ Google Scholar ]
- Huang, HC ; Liao, CC-C.; Wang, S.-H. ; Lee, I.-J. ; Lee, TA ; Hsu, J.-M. ; Kuo, C.-T.; Wang, J. ; Hsieh, WC; Chang, S.-J. ; et coll. Le pic hyperglycosylé de la variante Gamma du SRAS-CoV-2 induit des métastases du cancer du sein. Suis. J. Cancer Rés. 2021 , 11 , 4994-5005. [ Google Scholar ]
- Nunez-Castilla, J. ; Stebliankine, V. ; Baral, P. ; Balbin, Californie ; Sobhan, M. ; Cickovski, T. ; Mondal, AM; Narasimhan, G. ; Chapagain, P. ; Mathée, K. ; et coll. Auto-immunité potentielle résultant du mimétisme moléculaire entre le pic du SRAS-CoV-2 et les protéines humaines. Virus 2022 , 14 , 1415. [ Google Scholar ] [ CrossRef ]
- Dotan, A. ; Kanduc, D. ; Müller, S. ; Makatsariya, A. ; Shoenfeld, Y. Mimétisme moléculaire entre le SRAS-CoV-2 et le système reproducteur féminin. Suis. J. Reproduction. Immunol. 2021 , 86 , e13494. [ Google Scholar ] [ CrossRef ]
- Xu, W. ; Wen, X. ; Cong, X. ; Jiang, W. Le vaccin à ARNm COVID-19, mais pas un vaccin à base de vecteur viral, favorise la production neutralisante d’autoanticorps anti-interféron de type I dans un petit groupe d’individus en bonne santé. J.Méd. Virol. 2023 , 95 , e29137. [ Google Scholar ] [ CrossRef ]
- Murphy, WJ; Longo, DL Un rôle possible des anticorps anti-idiotypes dans l’infection et la vaccination par le SRAS-CoV-2. N. Engl. J.Méd. 2022 , 386 , 394-396. [ Google Scholar ] [ CrossRef ]
- Arlt, FA; Breuer, A. ; Trampenau, E. ; Boesl, F. ; Kirchner, M. ; Mertins, P. ; Sánchez-Sendín, E. ; Nasouti, M. ; Mayrhofer, M. ; Blüthner, M. ; et coll. Prévalence sérique élevée des anticorps IgG autoréactifs contre les structures nerveuses périphériques chez les patients atteints du syndrome neurologique de vaccination post-COVID-19. Devant. Immunol. 2024 , 15 , 1404800. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Bellucci, M. ; Bozzano, FM; Castellano, C. ; Pesce, G. ; Béronio, A. ; Farshchi, AH; Limongelli, A. ; Uccelli, A. ; Benedetti, L. ; De Maria, A. L’infection post-SRAS-CoV-2 et les complications neurologiques liées au vaccin partagent des caractéristiques cliniques et la même positivité aux anticorps anti-ACE2. Devant. Immunol. 2024 , 15 , 1398028. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Mulroney, TE; Poyry, T. ; Yam-Puc, JC; Rouille, M. ; Harvey, RF; Kalmar, L. ; Horner, E. ; Booth, L. ; Ferreira, AP; Stoneley, M. ; et coll. La N1-méthylpseudouridylation de l’ARNm provoque un décalage du cadre ribosomal +1. Nature 2024 , 625 , 189-194. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Tang, J. ; Zeng, C. ; Cox, TM; Li, C. ; Fils, YM; Cheon, EST ; Wu, Y. ; Behl, S. ; Taylor, JJ; Chakaraborty, R. ; et coll. Immunité des muqueuses respiratoires contre le SRAS-CoV-2 après vaccination à ARNm. Sci. Immunol. 2022 , 7 , eadd4853. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Mitsi, E. ; Diniz, Missouri ; Reiné, J. ; Collins, AM; Robinson, RE; Hyder-Wright, A. ; Farrar, M. ; Liatsikos, K. ; Hamilton, J. ; Onyema, O. ; et coll. Mémoire immunitaire des muqueuses respiratoires contre le SRAS-CoV-2 après infection et vaccination. Nat. Commun. 2023 , 14 , 6815. [ Google Scholar ] [ CrossRef ]
- Soleil, B. ; Wang, Q. ; Zheng, P. ; Niu, X. ; Feng, Y. ; Guan, W. ; Chen, S. ; Li, J. ; Cui, T. ; Deng, Y. ; et coll. Un vaccin contre le SRAS-CoV-2 à vecteur adénovirus administré par voie intranasale induit des IgA sécrétoires muqueuses robustes. JCI Insight 2024 , 9 , e180784. [ Google Scholar ] CrossRef [
- Maman, B. ; Tao, M. ; Li, Z. ; Zheng, Q. ; Wu, H. ; Chen, P. Vaccins muqueux contre les maladies virales : état et perspectives. Virologie 2024 , 593 , 110026. [ Google Scholar ] [ CrossRef ]
- Rathore, APS ; St. John, AL Promesses et défis des vaccins muqueux contre la COVID-19. Vaccin 2023 , 41 , 4042-4049. [ Google Scholar ] [ CrossRef ]
- Allie, SR ; Bradley, JE; Mudunuru, U. ; Schultz, MD; Graf, BA; Lund, FE ; Randall, TD L’établissement de cellules mémoire B résidentes dans les poumons nécessite une rencontre locale avec un antigène. Nat. Immunol. 2019 , 20 , 97-108. [ Google Scholar ] [ CrossRef ]
- Planas, D. ; Bruel, T. ; Grzelak, L. ; Guivel-Benhassine, F. ; Staropoli, I. ; Porrot, F. ; Planchais, C. ; Buchrieser, J. ; Rajah, MM ; Évêque, E. ; et coll. Sensibilité des variantes infectieuses du SRAS-CoV-2 B.1.1.7 et B.1.351 aux anticorps neutralisants. Nat. Méd. 2021 , 27 , 917-924. [ Google Scholar ] [ CrossRef ]
- Tang, Y. ; Boribong, BP; Swank, ZN ; Démokritou, M. ; Luban, MAF; Fasano, A. ; Du, M. ; Loup, RL ; Griffiths, J. ; Shultz, J. ; et coll. Les vaccins à ARNm contre la COVID-19 induisent des niveaux élevés d’IgG mais des quantités limitées d’IgA dans l’oronasopharynx des jeunes enfants. J. Infecter. Dis. 2024 , jiae450. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Oda, Y. ; Kumagai, Y. ; Kanaï, M. ; Iwama, Y. ; Okura, moi; Minamida, T. ; Yagi, Y. ; Kurosawa, T. ; Plus vert, B. ; Zhang, Y. ; et coll. Immunogénicité et innocuité d’une dose de rappel d’un vaccin auto-amplificateur à ARN contre la COVID-19 (ARCT-154) par rapport au vaccin à ARNm BNT162b2 contre la COVID-19 : un essai de non-infériorité en double aveugle, multicentrique, randomisé et contrôlé. Lancet Infecter. Dis. 2024 , 24 , 351-360. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Dolgin, E. Le vaccin à ARN autocopiant remporte la première approbation complète : quelle est la prochaine étape ? Nature 2023 , 624 , 236-237. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Uversky, VN ; Redwan, EM; Makis, W. ; Rubio-Casillas, A. Les anticorps IgG4 induits par une vaccination répétée peuvent générer une tolérance immunitaire à la protéine Spike du SRAS-CoV-2. Vaccins 2023 , 11 , 991. [ Google Scholar ] [ CrossRef ]
- Irrgang, P. ; Gerling, J. ; Kocher, K. ; Lapuente, D. ; Steininger, P. ; Habenicht, K. ; Wytopil, M. ; Beileke, S. ; Schäfer, S. ; Zhong, J. ; et coll. Changement de classe vers des anticorps IgG4 non inflammatoires spécifiques aux pointes après une vaccination répétée à l’ARNm du SRAS-CoV-2. Sci. Immunol. 2023 , 8 , eade2798. [ Google Scholar ] [ CrossRef ]
- Zhu, F. ; Huang, S. ; Liu, X. ; Chen, Q. ; Zhuang, C. ; Zhao, H. ; Han, J. ; Jaén, AM; Faites, TH; Peter, JG ; et coll. Sécurité et efficacité du vaccin intranasal contre le SRAS-CoV-2 dNS1-RBD : un essai de phase 3 multicentrique, randomisé, en double aveugle, contrôlé par placebo. Lancette Respir. Méd. 2023 , 11 , 1075-1088. [ Google Scholar ] [ CrossRef ]
| Avis de non-responsabilité/Note de l’éditeur : Les déclarations, opinions et données contenues dans toutes les publications sont uniquement celles du ou des auteurs et contributeurs individuels et non de MDPI et/ou du ou des éditeurs. MDPI et/ou le(s) éditeur(s) déclinent toute responsabilité pour tout préjudice corporel ou matériel résultant des idées, méthodes, instructions ou produits mentionnés dans le contenu. |
© 2024 par l’auteur. Licencié MDPI, Bâle, Suisse. Cet article est un article en libre accès distribué selon les termes et conditions de la licence Creative Commons Attribution (CC BY) ( https://creativecommons.org/licenses/by/4.0/ ).
